Нитроантрахинoны
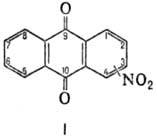
НИТРОАНТРАХИНOНЫ, соединение общей формулы C14H8_nO2(NO2)n. Наиб. практич. значение имеют моно-нитроантрахиноны ф-лы I-1- и 2-нитроантрахиноны, а также 1,5- и 1,8-динитро-антрахиноны-светло-желтые или желтые кристаллы (см. табл.); хорошо раств. в бензоле, нитробензоле, хлорбензоле, СН3Сl, СН3СООН, плохо-в этаноле, диэтиловом эфире, не раств. в воде.
Мн. производные нитроантрахинонов под действием избытка Na2 S при 95-98 °С восстанавливаются до аминоантрахтонов. 1-Нитроантрахиноны, в к-рых в положении 4 находится атом галогена или вторая нитрогруппа, обычно восстанавливаются действием металла в кислой среде; напр., 1-амино-4-хлорнитроантрахинон получают восстановлением соответствующего нитропроиз-водного железом в 90%-ной H2SO4. При нитровании или сульфировании 1-и 2-нитроантрахинонов нитро- или сульфогруппа вступают в незамещенное ядро антрахинона. Например, при сульфи-ровании 1-нитроантрахинона образуется смесь 1-нитроантрахинон-5- и 1-нитроантрахшюн-8-сульфокислот, при сульфировании 2-нитроантрохинона -смесь 1-нитроантрахинон-6- и 1-нитроантрахинон-7-сульфокислот. При хлорировании 1-нитроантрахинона хлорсульфоновой кислотой в олеуме или под действием Сl2 с хорошим выходом получается 1-нитро-5,8-дихлорантрахинон.
СВОЙСТВА НЕКОТОРЫХ НИТРОАНТРАХИНОНОВ
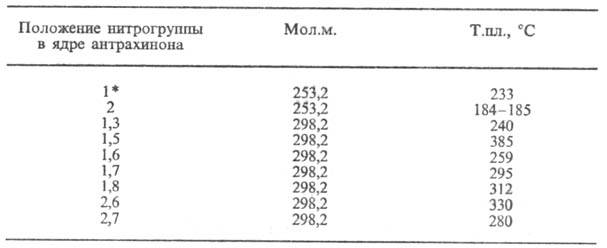
* Т.кип. 270-271 °С/7 мм рт .ст.
Нитрогруппа в нитроантрахинонах обменивается на др. группы (амино-, гидрокси-, алкоксигруппы), причем в случае 1-нитроантрахинона обычно легче, чем в случае 2-нитроантрахинона. Так, 1-нитроантрахинон и 1,5-динитроантрахинон с 25%-ным водным р-ром NH3 под давлением при 150-170°С в разл. р-рителях (хлорбензол, ксилол, сульфолан) превращ. соотв. в 1-амино- и 1,5-диаминоантрахиноны; 1,6- и 1,7-ди-нитроантрахиноны при взаимод. с ароматич. аминами при 150-180°С замещают нитрогруппу в положении 1 на аминогруппу. При нагр. с 15-20%-ным водным р-ром КОН (150 °С) или с Са(ОН)2 (200 °С) 1-нитроантрахинон, 1,5- и 1,8-динитро-антрахиноны образуют соотв. моногидрокси- или дигидрок-сиантрахиноны; 1,6- и 1,7-динитроантрахиноны в тех же условиях замещают на гидроксил только группу NO2 в положении 1. При взаимод. с метилатом Na нитроантрахиноны превращ. в соответствующие метоксиантрахиноны.
Нагревание 1-нитроантрахинона с Na2S2O3 приводит к образованию 1-антрахинонсульфокислоты, 2-нитроантрахинон в тех же условиях превращ. в смесь 2-аминоантрахинона (60-65%), 2-сульфамино-антрахинона (16-19%) и 3-аминоантрахинока-2-сульфо-кислоты; 1-нитро-2-метилантрахинон реагирует только под давлением.
В пром-сти 1-нитроантрахинон получают гл. обр. нитрованием антра-хинона избытком конц. HNO3 в конц. H2SO4 или 85-95%-ной HF при 20-25°С (выход 60-70%); 2-нитроантрахинон -окисле-нисм 2-аминоантрахинона надсерной к-той. 1- И 2-нитроантрахиноны м. б. также получены диеновым синтезом из 1,4-нафтохинона, напр.:
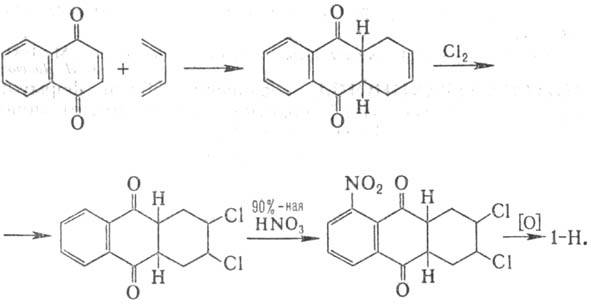
1,5- И 1,8-Динитроантрахиноны синтезируют нитрованием 1-нитроантрахинона или антрахииона смесью конц. HNO3 и H2SO4 при 40-70°С (выход 40,5 и 36,2% соотв.); побочные Продукты-1,6-, 1,7-, 2,6- и 2,7-динитропроизводные.
Нитроантрахиноны-промежут. продукты в синтезе красителей; 1-нитроантрахинон используют для получения 1-аминоантрахинона, применяемого в произ-ве 1-амино-4-бромантрахинон-2-сульфокисло-ты (бромаминовой к-ты), 1,5- и 1,8-динитроантрахиноны-полупродукты при получении синих дисперсных красителей.
Лит.: Горелик М. В., Химия антрахинонов и их производных, М., 1983; Kirk-Othmer encyclopedia. 3 ed., v. 2, N.Y., 1978, p. 716-19.
С. И. Диденко.
