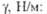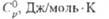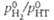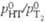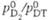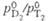Тритий
ТРИТИЙ (от греч. tritos - третий) T, или 31H, радиоактивный тяжелый изотоп водорода с мас. ч. 3. Ядро атома трития- тритон с массой 3,016050 состоит из одного протона и двух нейтронов, энергия связи 8,1-8,4 МэВ. При b-распаде трития образуется легкий изотоп гелия: 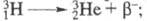 Т1/2 12,33 года; макс. энергия излучения 18,61 кэВ, средняя - 5,54 кэВ. Уд. активность трития 3,59 · 105 ГБк/г. При взаимод.
Т1/2 12,33 года; макс. энергия излучения 18,61 кэВ, средняя - 5,54 кэВ. Уд. активность трития 3,59 · 105 ГБк/г. При взаимод.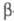 -частиц трития с в-вом возникает тормозное фотонное излучение, к-рое используют для количеств. определения трития в разл. средах.
-частиц трития с в-вом возникает тормозное фотонное излучение, к-рое используют для количеств. определения трития в разл. средах.
Молекула трития двухатомна, мол. м. 6,03210; основная частота колебаний атомов 2548,36 см-1; константа диссоциации 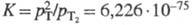 (293,15 К), где p - давление. С др. изотопами водорода тритий образует молекулы прототри-тия HT с мол.м. 4,02395 и дейтеротрития DT с мол. м. 5,03015. Молекулярный тритий может находиться в орто-и пара-состояниях (соотв. о-Т2 и п-Т2). При обычных условиях газообразный T2 представляет собой смесь 75% орто- и 25% пара-модификаций (нормальный тритий, н-T2). Равновесный тритий (р-Т2), имеющий равновесный орто-пара-состав при данной т-ре, содержит п-T2, (%): 97,243 (10 К), 66,453 (20 К), 43,493 (30 К), 33,35 (40 К), 28,789 (50 К), 25,075 (100 К). Энтальпия орто-пара-превращения н-T2 в р-Т2 составляет -195,94 при 20 К и -11,51 Дж/моль при 50 К.
(293,15 К), где p - давление. С др. изотопами водорода тритий образует молекулы прототри-тия HT с мол.м. 4,02395 и дейтеротрития DT с мол. м. 5,03015. Молекулярный тритий может находиться в орто-и пара-состояниях (соотв. о-Т2 и п-Т2). При обычных условиях газообразный T2 представляет собой смесь 75% орто- и 25% пара-модификаций (нормальный тритий, н-T2). Равновесный тритий (р-Т2), имеющий равновесный орто-пара-состав при данной т-ре, содержит п-T2, (%): 97,243 (10 К), 66,453 (20 К), 43,493 (30 К), 33,35 (40 К), 28,789 (50 К), 25,075 (100 К). Энтальпия орто-пара-превращения н-T2 в р-Т2 составляет -195,94 при 20 К и -11,51 Дж/моль при 50 К.
Тритий образуется в верх. слоях атмосферы в результате взаимод. космич. излучения гл. обр. с ядрами N и O, напр.:  . Образующиеся таким образом атомы трития в результате р-ций радиац. окисления и изотопного обмена переходят в молекулы воды, затем тритий в составе дождевой воды выпадает на пов-сть Земли. По совр. оценкам, равновесная активность космогенного трития во внеш. среде (гидросфере и атмосфере) составляет (1,11-1,30)·109 ГБк (3,0-3,5 кг). Считают, что ок. 90% природного трития содержится в гидросфере (гл. обр. в виде НТО), 10% в стратосфере (НТО) и 0,1% и тропосфере (из них 50% в виде HT).
. Образующиеся таким образом атомы трития в результате р-ций радиац. окисления и изотопного обмена переходят в молекулы воды, затем тритий в составе дождевой воды выпадает на пов-сть Земли. По совр. оценкам, равновесная активность космогенного трития во внеш. среде (гидросфере и атмосфере) составляет (1,11-1,30)·109 ГБк (3,0-3,5 кг). Считают, что ок. 90% природного трития содержится в гидросфере (гл. обр. в виде НТО), 10% в стратосфере (НТО) и 0,1% и тропосфере (из них 50% в виде HT).
Большое кол-во трития образуется при ядерных и, гл. обр., термоядерных взрывах. Взрыв водородной бомбы с тротиловым эквивалентом 1 MT приводит к выделению (2,6-7,4)*108 ГБк трития. С начала испытания термоядерного оружия (1954) содержание трития в дождевой воде возросло с 0,5-5,0 до 500 Т.E.: Т.E. - тритиевая единица, равная отношению числа атомов Т/Н = 10-18, или 0,12 Бк на 1 л воды. При подземных ядерных взрывах тритий также превращ. в оксид и частично выходит на пов-cть. По оценкам (1970), общее содержание трития в биосфере: в мировом океане 250 кг, в континентальных водах 45 кг, в воздухе 3 кг.
Свойства. Нек-рые св-ва трития приведены в табл. 1. Ур-ние температурной зависимости давления насыщ. пара жидкого н-Т2 в интервале 25-40 К: 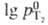 (гПа) = 6,158 +78,925/T+2*10-4(T-25)2.
(гПа) = 6,158 +78,925/T+2*10-4(T-25)2.
Tабл. 1. - СВОЙСТВА HT, DT и н-Т2
| Показатель | HT | DT | н-T2 |
| tкрит, K | 37,13 | 39,42 | 40,44 |
| | 1,571 | 1,773 | 1,850 |
| Т-ра тройной точки, К | 17,62 | 19.71 | 20,62 |
| Т. кип., К | 22,92 | 24,38 | 25,04 |
| AHисп при т. кип., Дж/моль | — | — | 1394 |
| | | | |
| 21 К | 162.8 | 220,7 | 272,2 |
| 23 К | 157,S | 214,6 | 265,0 |
| 25 К | 152,3 | 208.1 | 257,3 |
| | | | |
| 21 К | 3,035 | 3,793 | 4,181 |
| 23 К | 2,607 | 3,327 | 3,694 |
| 25 К | 2,180 | 2,860 | 3,207 |
| | 29,198 | 29,195 | 29,199 |
Давление пара HT м. б. вычислено по ф-ле: 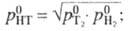 аналогично принято, что
аналогично принято, что 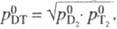 Коэф. диффузии HT в жидком H2 м.б. вычислен по ур-нию D = 3,05*10-4exp(-36/T). Идеальный коэф. разделения изотопов водорода при равновесии жидкость-пар
Коэф. диффузии HT в жидком H2 м.б. вычислен по ур-нию D = 3,05*10-4exp(-36/T). Идеальный коэф. разделения изотопов водорода при равновесии жидкость-пар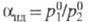 (см. табл. 2). Эксперим. коэф. разделения смесей D2-DT и D2-T2 на 5-6% ниже
(см. табл. 2). Эксперим. коэф. разделения смесей D2-DT и D2-T2 на 5-6% ниже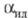 Р-ции изотопного обмена водорода
Р-ции изотопного обмена водорода  и
и (константы равновесия при 298,15 К равны соотв. 2,57 и 3,82) протекают вследствие выделения энергии при радиоактивном распаде трития, скорость их зависит от концентрации трития, а также от присутствия катализаторов. Тритий окисляется O2 при обычной т-ре и без катализаторов вследствие
(константы равновесия при 298,15 К равны соотв. 2,57 и 3,82) протекают вследствие выделения энергии при радиоактивном распаде трития, скорость их зависит от концентрации трития, а также от присутствия катализаторов. Тритий окисляется O2 при обычной т-ре и без катализаторов вследствие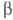 -распада.
-распада.
Табл.2.- ЗНАЧЕНИЯ 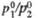
| Т-ра, К | | | | |
| 21,0 22,0 23,0 24,0 | 2,19 2,06 1,95 1,86 | 2,18 2,05 1,94 | 1,30 1,27 1,25 1,23 | 1,690 1,613 1,563 1,513 |
Оксиды трития T2O (мол.м. 22,03150), прототрития НТО (20,02335) и дейтеротрития DTO (21,02955) имеют уд. активность соотв. 98050, 53650 и 51430 ГБк/г. Для T2O т. кип. 274,70 К, т-ра тройной точки 277,64 К; плотн. 1,21459 г/см3 (293,15 К), макс. плотн. 1,21502 (286,55 К); отношение значений давления паров H2O и T2O в интервале 264-387 К: 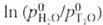 = -103,87/Т+ 46480/Т2.
= -103,87/Т+ 46480/Т2.
Давление пара НТО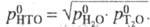 Коэф. разделения жидкость - пар (относит, летучесть
Коэф. разделения жидкость - пар (относит, летучесть 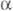 ) р-ров DTO в D2О в интервале 313,15-373,15 К:
) р-ров DTO в D2О в интервале 313,15-373,15 К: 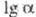 =8,026/7+0,0198. Коэф. диффузии (м2/с) при 298,15 К: НТО в H2O 2,236-10-9, DTO в D2O 1,849*10-9, DTO в НТО 2,029*10-9.
=8,026/7+0,0198. Коэф. диффузии (м2/с) при 298,15 К: НТО в H2O 2,236-10-9, DTO в D2O 1,849*10-9, DTO в НТО 2,029*10-9.
Константы равновесия К изотопного обмена H2O+ и D2O +
и D2O + при 300 К соотв. равны 3,699 и 3,972. Образование НТО может происходить при изотопном обмене
при 300 К соотв. равны 3,699 и 3,972. Образование НТО может происходить при изотопном обмене 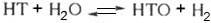 , К = 6.31 (300 К).
, К = 6.31 (300 К).
В результате радиоактивного распада трития в его соед. имеют место радиац. эффекты. Вода, содержащая тритий, подвергается радиолизу с образованием H2 и H2O2. Вода, содержащая 100% трития, разлагается на 50% через 5,24 сут. Рекомендуемая Международной комиссией радиологич. зашиты условная граница допустимого содержания трития в воде (при к-ром практически не наблюдается ее саморазложение) 3,7*103 ГБк/л.
Тритиды подобны гидридам (незначит. отличия проявляются в таких св-вах, как плотность и параметры кристаллич.решетки): получают их теми же методами, что и гидриды. Наиб. важны LiT (Li2DT), TiT2, ZrT2, UT3. Обьем (см3) T2, связываемого 1 г металла: Li 1,6*103, Ti 4,7*102, Zr2,5-102, U 1,4*102. В любом водородсодержащем соед. замещение одного атома H на атом T приводит к образованию соед. с уд. активностью 107,7-104 ГБк/моль.
Получение. В пром. масштабе тритий получают в ядерном реакторе, облучая Li, чаще всею обогащенный изотопом 6Li, нейтронами:  . Продукт естеств. распада трития- 3Не - также вступает в ядерную р-цию, превращаясь в тритий и протий:
. Продукт естеств. распада трития- 3Не - также вступает в ядерную р-цию, превращаясь в тритий и протий:  . Получение трития включает подготовку материала к облучению, проведение облучения и накопление трития в материале, выделение, очистку и концентрирование, при этом используют методы термодиффузии и низкотемпературной ректификации. Тритий может быть также получен выделением и концентрированием при изотопной очистке тяжелой воды - замедлителя ядерных реакторов. Этим путем на установке в Гренобле (Франция) получают 8,88-106 ГБк в год 98%-ного трития. Установка TRF (Tritium Removal Facility) в Канаде, рассчитанная на переработку 350 кг/ч D2O тяжеловодных реакторов, по аналогичной технологии позволяет получать ок. 109 ГБк в год трития чистотой не менее 99%. Хранить тритий можно в виде тритидов.
. Получение трития включает подготовку материала к облучению, проведение облучения и накопление трития в материале, выделение, очистку и концентрирование, при этом используют методы термодиффузии и низкотемпературной ректификации. Тритий может быть также получен выделением и концентрированием при изотопной очистке тяжелой воды - замедлителя ядерных реакторов. Этим путем на установке в Гренобле (Франция) получают 8,88-106 ГБк в год 98%-ного трития. Установка TRF (Tritium Removal Facility) в Канаде, рассчитанная на переработку 350 кг/ч D2O тяжеловодных реакторов, по аналогичной технологии позволяет получать ок. 109 ГБк в год трития чистотой не менее 99%. Хранить тритий можно в виде тритидов.
Применение. Тритий- компонент топлива для термоядерного синтеза:  МэВ: радиоактивный изотопный индикатор в химии, биологии, медицине, геофизике, гидрогеологии и др. В виде тритиевых мишеней (тритиды U, Ti, Zr, интерметаллиды) используется в генераторах нейтронов, детекторах для газо-жидкостной хроматографии, в качестве радиоактивных источников излучения для флюорографии, в толщиномерах и т.д. Тритий применяют при изготовлении световых указателей и сигналов (активированный ZnS излучает зеленоватое свечение в присутствии трития).
МэВ: радиоактивный изотопный индикатор в химии, биологии, медицине, геофизике, гидрогеологии и др. В виде тритиевых мишеней (тритиды U, Ti, Zr, интерметаллиды) используется в генераторах нейтронов, детекторах для газо-жидкостной хроматографии, в качестве радиоактивных источников излучения для флюорографии, в толщиномерах и т.д. Тритий применяют при изготовлении световых указателей и сигналов (активированный ZnS излучает зеленоватое свечение в присутствии трития).
Техника безопасности и контроль. Макс. пробег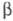 -частиц трития в воздухе 5,8 мм при 20 0C, в биол. ткани 6,5 мкм. Поэтому
-частиц трития в воздухе 5,8 мм при 20 0C, в биол. ткани 6,5 мкм. Поэтому 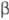 -частицы трития полностью поглощаются роговыми слоями кожи и внеш. облучение организма тритием и его соед. не представляет опасности. Тритий опасен при попадании в организм через кожу, легкие или при приеме пищи и воды. Период полувыведения трития при поглощении в виде газа 3,3 мин, а в виде воды 10-12 сут. Независимо от путей поступления в организм через 2-3 ч наблюдается равномерное распределение НТО в жидкой фазе организма (кровь, моча, выдыхаемые пары воды). Для газообразного трития и НТО (T2O) категория радиац. опасности Г, минимально значимая активность 3,7 · 106 Бк. Допустимые концентрации трития в воздухе рабочей зоны ДКА и в атм. воздухе или воде ДКБ, предельно допустимое поступление через органы дыхания ПДП, предел годового поступления в организм ПГП приведены в табл. 3.
-частицы трития полностью поглощаются роговыми слоями кожи и внеш. облучение организма тритием и его соед. не представляет опасности. Тритий опасен при попадании в организм через кожу, легкие или при приеме пищи и воды. Период полувыведения трития при поглощении в виде газа 3,3 мин, а в виде воды 10-12 сут. Независимо от путей поступления в организм через 2-3 ч наблюдается равномерное распределение НТО в жидкой фазе организма (кровь, моча, выдыхаемые пары воды). Для газообразного трития и НТО (T2O) категория радиац. опасности Г, минимально значимая активность 3,7 · 106 Бк. Допустимые концентрации трития в воздухе рабочей зоны ДКА и в атм. воздухе или воде ДКБ, предельно допустимое поступление через органы дыхания ПДП, предел годового поступления в организм ПГП приведены в табл. 3.
В ядерных реакторах, работающих на тепловых нейтронах, в результате побочных процессов образуется тритий, к-рый может попадать в окружающую среду с газообразными или жидкими отходами, как непосредственно на АЭС, так и при дальнейшей переработке облученного ядерного топлива. Количеств. оценка поступления трития в окружающую среду с газообразными и жидкими отходами АЭС, ГБк/МВт(электрич.)*год: реакторы ВВЭР (водно-водяной энергетич. реактор) - в атмосферу 7,4-33, в гидросферу 33; реакторы РБМК (реактор большой мощности канальный) - соотв. 22 и 1,5. Существенно более высокие выбросы трития наблюдаются на АЭС с тяжеловодными реакторами. Осн. источник поступления трития в окружающую среду в ядерной технологии - заводы по переработке ядерного топлива. Так, напр., завод по переработке ядерного топлива с производительностью 1500 т UO2 в год м.б. источником трития- (1,11-2,96)·1016 Бк в год.
Табл. 3.- ЗНАЧЕНИЯ ДОПУСТИМЫХ КОНЦЕНТРАЦИЙ ТРИТИЯ
| Дтя категории А: | |||
| Состояние трития | Критич. орган | ПДП, Бк/год | ДКА, Бк/л |
| Газ | Все тело | 5.55 ·1012 | 22,2 ·105 |
| НТО (T2O) | Все тело | 4,4·108 | 3,7 · 102 |
| Для категории Б: | |||
| Состояние трития | Критич. орган | ПДП, Бк/год через органы дыхания | ДКК, Б к/л |
| в атм. воздухе в воде | |||
| Газ | Все тело | .5,55 ·1011 | 7,4·104 — |
| НТО (T2O) | Все тело | 7,4·107 | 11,1 14,8 · 104 |
Эксплуатация термоядерных энергетич. установок будущего приведет к дальнейшему росту выбросов трития, т.к. ТЯЭС (термоядерная энергетич. станция) по оценкам будет выделять трития в 104-106 раз больше, чем АЭС эквивалентной мощности. Задачи улавливания трития и очистки сбросов до санитарных норм, выделения и концентрирования трития с целью его локализации (захоронения) или использования м. б. решены при помощи методов разделения изотопов водорода: ректификацией воды под вакуумом, хим. изотопным обменом (очистка и начальное концентрирование), низкотемпературной ректификацией жидкого водорода, сорбционным разделением на твердых сорбентах. Содержание трития в разл. средах определяют измерением его активности чаще всего ионизационными и сцинтилляционными методами (табл. 4). При недостаточной чувствительности измерит, аппаратуры применяют методы предварит, концентрирования (термодиффузия, ректификация, электролиз).
Табл. 4.- ХАРАКТЕРИСТИКА НАИБОЛЕЕ УПОТРЕБЛЯЕМЫХ МЕТОДОВ ОПРЕДЕЛЕНИЯ ТРИТИЯ
| Детектор | Миним. детектируемая активность трития, Бк | Пределы измерения концентрации трития в воде, Бк/л |
| Пропорциональный счетчик | 3,7·10-2 | 3,7·(10-106) |
| Счетчик Гейгера- Мюллера | 3,7·10-2 | 18,5- 3,7·105 |
| Жидкостной сцинтилляц. счетчик совпадений | 0,37 | 1,85·102-3,7·108 |
| Ионизац. камера | 3,7· I02 | 1,85·105-3,7·1014 |
Для контроля за содержанием трития в воздухе используют ионизац. камеры [диапазон измеряемых концентраций 3,7·(10-1013) Бк/л], пропорциональные (1,85-3,7·106 Бк/л) и сцинтилляц. счетчики [3,7·(10-1O7) Бк/л], для периодич. контроля - фотопленки. Тритий открыли в 1934 Э. Резерфорд, M. Олифант и П. Хартек.
Лит.: Ленский Л. А., Физика и химия трития, M., 1981; Беловодский Л.Ф., Гаевой В. К., Гришмановский В. И., Тритий, M., 1985; Андреев Б. M., Зельвенский Я.Д., Катальников С.Г., Тяжелые изотопы водорода в ядерной технике, M., 1987; Вредные химические вещества. Радиоактивные вещества. Справочник, под ред. Л. А. Ильина, В. А. Филова, Л., 1990, с. 50-57. Я. Д. Зельвенский.

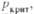 МПа
МПа