Характеристика халькогенов
ХАРАКТЕРИСТИКА ХАЛЬКОГЕНОВ
| Показатель | О | S | Se | Те | Po | ||
| Ат. номер | 8 | 16 | 34 | 52 | 84 | ||
| Ат. масса | 15,9994 | 32,066 | 78,96 | 127,60 | 208,9824 | ||
| Ковалентный ат. радиус, нм | 0,066 | 0,104 | 0,16 | 0,17 | 0,153 | ||
| Ионный радиус для X6+, нм | 0,009 | 0,034 | 0,035 | 0,056 | 0,056 | ||
| Первый потенциал ионизации, эВ | 13,61819 | 10,360 | 9,752 | 9,010 | 8,43 | ||
| Сродство к электрону, эВ | 1,465 | 2,07 | 2,02 | 1,96 | 1,87 | ||
| Электроотрицательность по Полингу | 3,50 | 2,50 | 2,40 | 2,10 | 1,76 | ||
| Энергия диссоциации X2 | 493,57 | 426 | 309 | 263 | 186 | ||
| Содержание в земной коре, % по массе | 47 | 0,05 | 1,4·10-5 | 1·10-6 | 2·10-14 | ||
Наличие в атоме двух неспаренных р-электронов обусловливает возможность образования молекул X2 с двойной связью (O2, S2, Se2) либо молекул, катионов, анионов цепочечного (O3, S3, Se5, 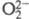 ,
, 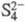 и др.) или кольцевого строения (напр., S6, S7, S8, S9, S12, Se8,
и др.) или кольцевого строения (напр., S6, S7, S8, S9, S12, Se8, 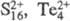 ) с простой связью. Способность халькогенов к образованию связей X —X —X... с ростом ат. н. падает.
) с простой связью. Способность халькогенов к образованию связей X —X —X... с ростом ат. н. падает.
Существует много аллотропных модификаций халькогенов. Для кислорода известны 2 формы - O2 и O3 (озон), для серы - более 6. Селен образует аморфную, стеклообразную и 6 кристаллич. модификаций, для Те известны аморфная и 3 кристаллич. формы, для полония - 2 кристаллические.
Все халькогены - окислители. Наиб. активен кислород, образующий оксиды со всеми элементами, кроме Не, Ar, Ne, Kr, с фтором дает фториды. Окислит. способность халькогенов с ростом ат. н. уменьшается. С H2 халькогены дают халькогеноводороды H2X, термич. устойчивость к-рых с ростом ат. н. снижается. Жидкие H2X способны к автопротолизу, в водном р-ре являются слабыми двухосновными к-тами. H2X, кроме воды,- типичные восстановители, их восстановит, способность растет в ряду от H2S к H2Po. Халькогены образуют ионно-ковалентные (с элементами Ia, IIа, 16, IIб гр.), ковалентно-металлич. (с d- и f-элементами) и ковалентно-ионные (с р-элементами) соед. (халькоге-ниды) разнообразного состава, многие из к-рых обладают полупроводниковыми cв-вами (см. Селениды, Сульфиды неорганические, Теллуриды).
Взаимод. халькогенов с O2 получают кислотные оксиды XO2 образующие с водой двухосновные к-ты средней силы H2XO3, где X = S, Se, Те. Сила к-т и их восстановит. св-ва убывают в ряду от S к Те. Оксидам XO3 отвечают сильные к-ты H2XO4 и слабая к-та H6TeO6. Окислит. св-ва наиб. характерны для H2SeO4. Оксоанионы 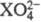 способны к поликонденсации с образованием цепочек X —О —X—O—... (напр., Na2S2O7), О —X —X—... (Na2S2O3, Na2S4O6), X — О—О — X-... (Na2S2O8). Соед. халькогенов между собой (напр., Se3S5, TeS7) - это гл. обр. продукты замещения атомов одного халькогена другим в циклич. молекулах X8. Р-цией халькогенов с галогенами получают галогениды, а также оксогалогениды (XHal2O, XHal2O2 и др.), к-рые при гидролизе водой дают HHal и халькогенокислород-ные к-ты. Фториды более устойчивы к гидролизу и склонны к образованию комплексов.
способны к поликонденсации с образованием цепочек X —О —X—O—... (напр., Na2S2O7), О —X —X—... (Na2S2O3, Na2S4O6), X — О—О — X-... (Na2S2O8). Соед. халькогенов между собой (напр., Se3S5, TeS7) - это гл. обр. продукты замещения атомов одного халькогена другим в циклич. молекулах X8. Р-цией халькогенов с галогенами получают галогениды, а также оксогалогениды (XHal2O, XHal2O2 и др.), к-рые при гидролизе водой дают HHal и халькогенокислород-ные к-ты. Фториды более устойчивы к гидролизу и склонны к образованию комплексов.
В природе широко распространены и встречаются в свободном состоянии O и S, кроме того, S, Se и Те встречаются в виде минералов халькофильных элементов, О - в виде силикатов, прир. карбонатов, фосфатов, оксидов и др.
Лит.: Inorganic chemistry, ser. 1, v. 2, Main group elements: groups V and VI, ed. by H. Emeleus, L., 1972; Inorganic chemistry, ser. 2, v. 3, Main group elements: groups VI and Vn, ed. by H. Emeleus, L., 1975; Schmidt M., S i e b e r t W., Bagnall K., The chemistry of sulfur, selenium, tellurium and polonium, Oxf., 1975. Л. Ю. Аликберова.

 2Х, кДж/
2Х, кДж/