I. Реакции присоединения
1. Присоединение водорода. Присоединение водорода приводит к образованию предельных углеводородов: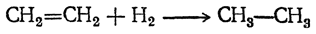
Присоединение элементарного водорода к этиленовым соединениям в отсутствие катализаторов происходит лишь при высоких температурах, при которых часто уже наблюдается разложение молекул органических веществ (реакция с самим этиленом является при этом обратимой). Значительно легче можно достигнуть присоединения водорода действием восстановителей, например иодистого водорода.
Самым удобным способом является присоединение водорода в присутствии катализаторов. Такими катализаторами служат металлы платиновой группы в мелко раздробленном виде, сама платина и особенно палладий — уже при обыкновенной температуре (С. А. Фокин, Вильштеттер). Большое практическое значение имело открытие Сабатье, применившего для этой цели мелко раздробленный никель при температуре 150—300° С и в многочисленных работах показавшего универсальность этого катализатора для целого ряда реакций восстановления.
2. Присоединение галоидов. Присоединением галоидов получаются дигалоидные соединения, содержащие галоиды при соседних атомах углерода:
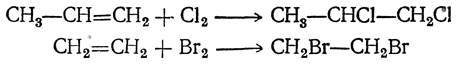
Наиболее энергично присоединяется хлор, труднее всего — иод. Реакцией присоединения брома часто пользуются как качественной реакцией на двойную и тройную связи. Признаком наличия двойной связи является моментальное обесцвечивание капли брома без выделения газообразного бромистого водорода.
3. Присоединение галоидоводородов. Легко присоединяются к двойной связи также и галоидоводороды, причем легче всего присоединяется иодистый водород и труднее всего — хлористый.
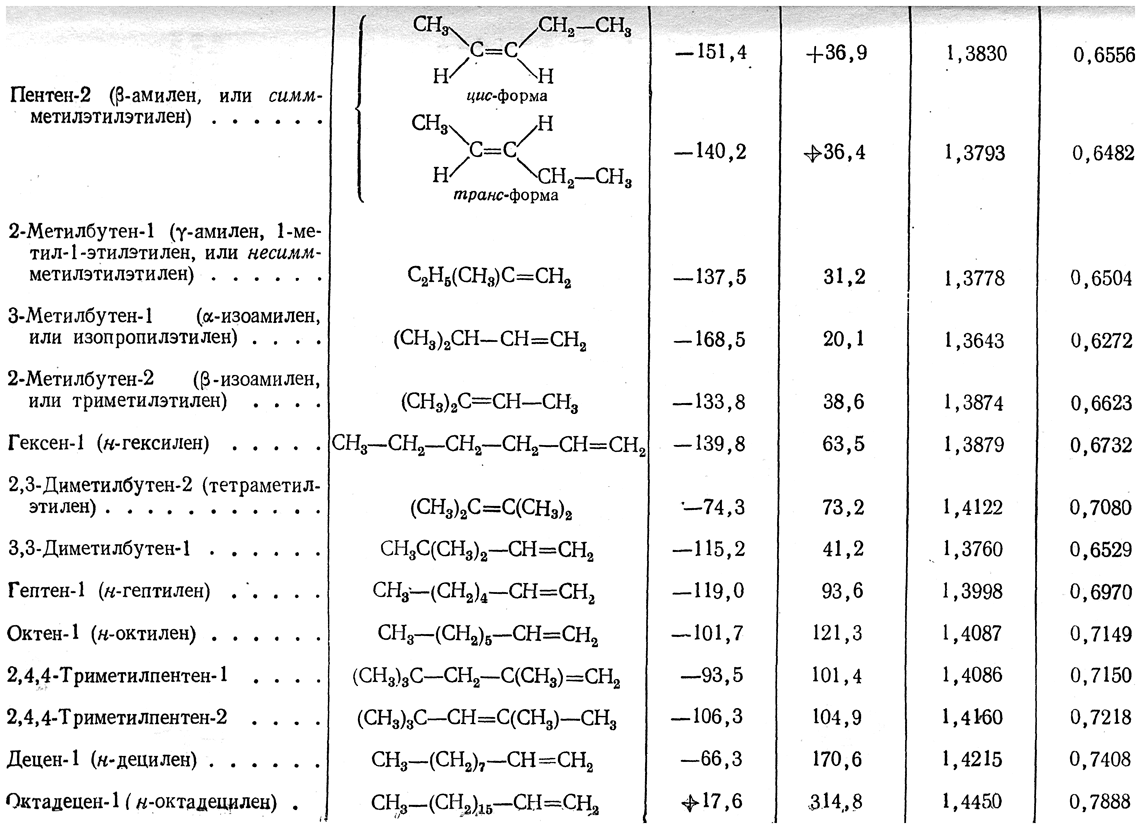
Первичный галоидный алкил получается лишь при присоединении галоидоводорода к самому этилену:
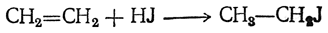
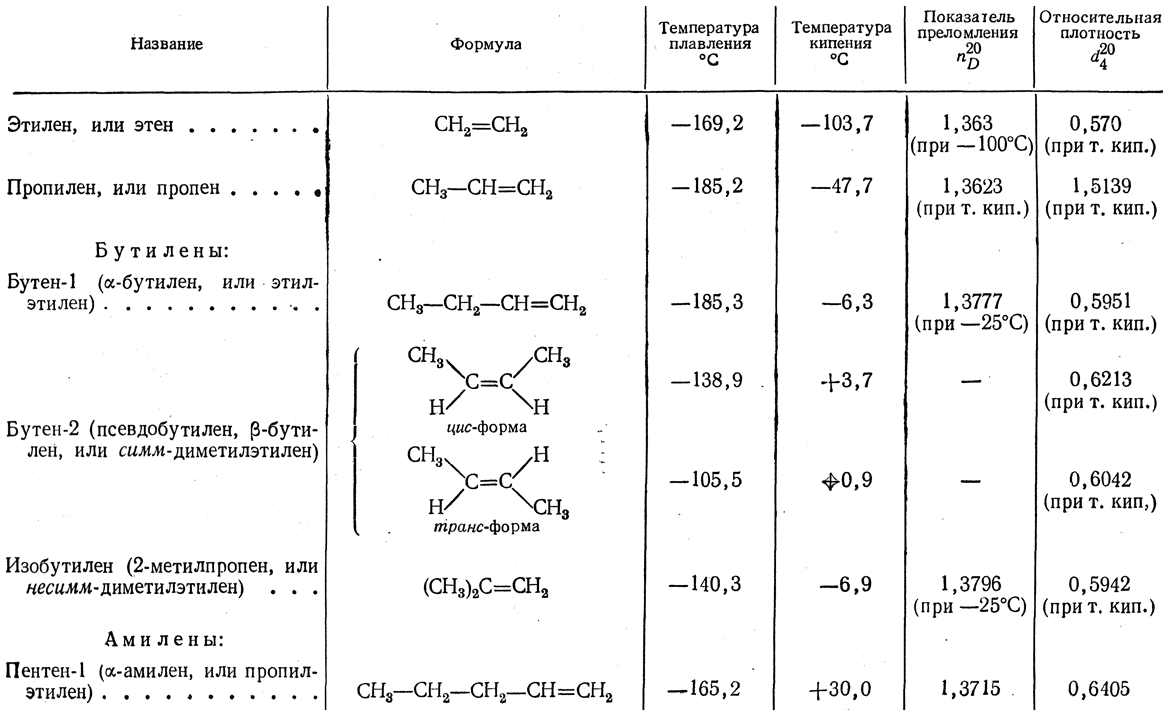
Этиленовые углеводороды
В других случаях присоединение идет главным образом так, что атом водорода направляется к тому атому углерода, где атомов водорода было больше (к наиболее «гидрогенизированному» атому углерода), а атом галоида — туда, где водорода было меньше, так что преимущественно получаются вторичные и третичные галоидные алкилы (см. правило Марковникова):
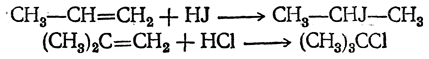
Особенно легко происходит присоединение (даже хлористого водорода) в тех случаях, когда может образоваться третичный галоидный алкил.
Присоединение других несимметричных реагентов типа Н—X к олефинам также обычно происходит в соответствии с правилом Марковникова.
Присоединение Н—Cl и Н—J протекает нормально, согласно правилу Марковникова. В случае же присоединения Н—Br соблюдение правила Марковникова в значительной степени зависит от условий реакции, в первую очередь от присутствия или отсутствия кислорода или перекисных соединений («перекисный эффект»). Реакции присоединения несимметричных реагентов к олефинам подробно изучались с учетом влияния перекисей (Хараш).
Различному поведению Н—Br в зависимости от условий реакции дается следующее объяснение:
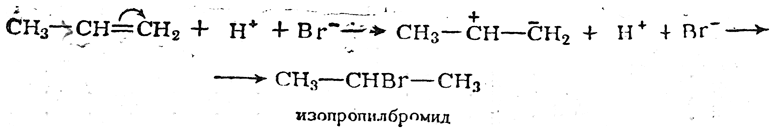
а) В отсутствие перекисей реакция идет по ионному механизму с поляризацией двойной связи (иногда для этого достаточно устранить кислород; в других случаях приходится добавлять антиоксиданты, например гидрохинон); при этом реакция протекает нормально в согласии с правилом Марковникова, т. е. анион реагента X– направляется к атому углерода с наименьшей плотностью электронного облака (к наименее гидрогенизированному атому), например:
б) В присутствии перекисей (в атмосфере, содержащей кислород, или при добавлении готовых перекисей) протекает возбуждаемая этими веществами свободнорадикальная цепная реакция, приводящая к аномальным продуктам:
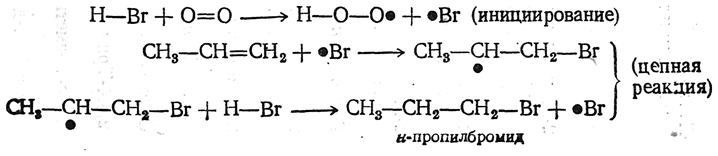
Под действием фтористого водорода олефины обычно полимеризуются; фтористый водород присоединяется сравнительно гладко лишь к галоидзамещенным олефинам.
4. Образование галоидгидринов. При взаимодействии с водными растворами хлора или брома олефины присоединяют элементы хлорноватистой (бромноватистой) кислоты, в результате чего образуются галоидгидрины, важные промежуточные продукты в современной технологии органического синтеза:
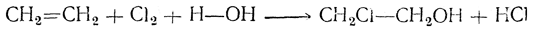
Если при атомах углерода содержится различнее число атомов водорода, то обычно гидроксил присоединяется преимущественно к менее гидрогенизированному атому углерода.
Приведенные схемы реакций отражают лишь конечные результаты процессов. В действительности присоединение галоидов к двойной связи совершается гораздо сложнее. Вероятный механизм процесса таков. Сначала происходит активация реагентов:
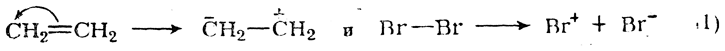
Далее олефин реагирует с положительным ионом брома:
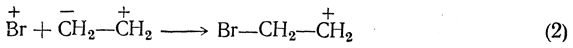
Затем присоединяется второй (отрицательный) ион брома:
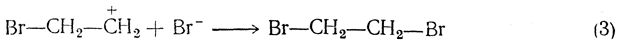
Если процесс протекает в водном растворе, то третьей стадией является реакция с участием ионов воды, приводящая к образованию галоидгидрина (и галоидоводородной кислоты):
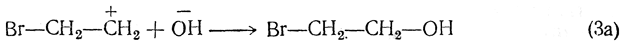
В пользу такого механизма процесса свидетельствуют следующие факты: а) В газовой фазе реакция между этиленом и галоидом практически не идет. Реакция происходит на внутренней поверхности реакционного сосуда, на стекле; если стекло покрыть слоем парафина, то скорость реакции делается ничтожной. Значит, чтобы процесс начался, нужны полярные катализаторы, и процесс, следовательно, имеет ионный характер.
б) Кинетический порядок реакции зависит от условий, существующих на поверхности сосуда, но скорость реакции всегда убывает с повышением температуры. Отрицательный температурный коэффициент свидетельствует о том, что реакция идет через образование малостойкого при повышенной температуре промежуточного продукта, а не путем непосредственного соединения компонентов.
в) При протекании процесса в водных растворах имеются две конкурирующие реакции (3 и За). Следовательно, относительный выход дибромэтана должен быть тем выше, чем больше концентрация анионов брома в растворе; действительно, при добавлении бромистого калия (т. е. К+ и Вr–) к раствору увеличивается выход BrСН2—СН2Br и уменьшается выход BrСН2—СН2ОН
5. Присоединение элементов воды. Присоединение элементов воды приводит к образованию спиртов, причем и в этом случае атом водорода направляется к наиболее гидрогенизированному, а гидроксил — к менее гидрогенизированному атому углерода, например
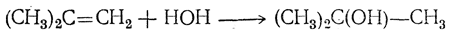
так что получаются вторичные или третичные спирты.
Присоединение воды может происходить под влиянием серной кислоты, хлористого цинка и тому подобных катализаторов. В случае серной кислоты сначала образуется алкилсерная кислота
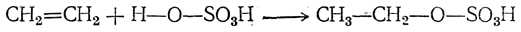
которая при последующем омылении дает спирт.
Эти реакции дают возможность превращать первичные соединения во вторичные или третичные. Так, отнимая воду от первичного пропилового спирта, можно получить пропилен СН3—СН=СН2, а присоединением молекулы воды к пропилену— вторичный (изопропиловый) спирт. Аналогичные превращения возможны при отщеплении и присоединении галоидоводородов.
6. Присоединение окислов азота и хлористогонитрозила. Этиленовые углеводороды способны присоединять высшие окислы азота, а также хлористый нитрозил NOCl. При этом часто получаются кристаллические продукты состава CnH2nN2O3, СnН2nN2O4 и СnН2nNОСl. В соединениях первых двух типов атомы азота присоединены частью непосредственно к углероду, частью через посредство кислорода (эфиры азотной или азотистой кислоты); в соединениях третьего типа атом азота присоединен непосредственно к углероду. Так, например, триметилэтилен с N2O4 и NOCl дает вещества следующего строения:

7. Присоединение озона. Озон присоединяется к этиленовым углеводородам с образованием озонидов строения
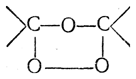
Озониды — обычно сильно взрывчатые вещества — при разложении водой распадаются по месту прежней двойной связи и дают альдегиды и кетоны:
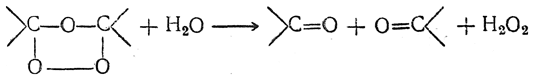
Строение образовавшихся альдегидов и кетонов дает возможность судить о строении этиленовых соединений; для этой цели реакция озонирования применяется очень часто.


