Палладий
ПАЛЛАДИЙ (назван в честь открытия планеты Паллада; лат. Palladium) Pd, хим. элемент VIII гр. периодич. системы, ат. н. 46, ат. м. 106,42; относится к платиновым металлам. Природный палладий состоит из шести стабильных изотопов: 102Pd (1,00%), 104Pd (11,14%), 105Pd (22,33%), 106Pd (27,33%), lo8Pd (26,46%) и 110Pd (11,72%). Наиб. долгоживущий искусств. радиоактивный изотоп 107Pd (Т1/2 7·106 лет). Мн. изотопы палладия в сравнительно больших кол-вах образуются при делении ядер U и Pu. В совр. ядерных реакторах в 1 т. ядерного топлива при степени выгорания 3%, содержится 1,5 кг палладия. Поперечное сечение захвата тепловых нейтронов ок. 8·10-28 м2. Конфигурация внеш. электронной оболочки атома 4d10; степени окисления 0, +1, +2 (наиб. часто), +3, + 4 (часто), +5, +6 (очень редко); энергия ионизации Pd0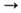 -> Pd+
-> Pd+  Pd2+
Pd2+  Pd3+ соотв. равна 8,336, 19,428 и 32,92 эВ; электроотрицательность по Полингу 2,2; атомный радиус 0,137 нм, ионные радиусы (в скобках даны координац. числа) Pd+f 0,073 нм (2), Pd2+ 0,078 нм (4, квадрат), 0,100 нм (6), Pd3 + 0,090 нм (6).
Pd3+ соотв. равна 8,336, 19,428 и 32,92 эВ; электроотрицательность по Полингу 2,2; атомный радиус 0,137 нм, ионные радиусы (в скобках даны координац. числа) Pd+f 0,073 нм (2), Pd2+ 0,078 нм (4, квадрат), 0,100 нм (6), Pd3 + 0,090 нм (6).
Палладий-один из наиб. редких элементов, его средняя концентрация в земной коре 1·10-6 % по массе. Встречается в самородном виде, в виде сплавов и соединений. Известно ок. 30 минералов, содержащих палладий: аллопалладий (содержит примеси Hg, Pt, Ru, Сu), палладистая платина (7-39% палладия), палладит PdO, станнопалладинит Pd3Sn2, стибиопаллади-нит Pd3Sb (содержит примеси PtAs2), брэггит (Pd, Pt, Ni) S (16-20% палладия) и др. Кол-во палладия в смеси платиновых металлов в разл. месторождениях колеблется от ~25% (ЮАР) до 43-45% (Канада) и 60% (СССР, по оценкам).
Свойства. Палладий-серебристо-белый металл с гранецентрир. кубич. решеткой типа Сu, а = 0,38902 нм, z = 4, пространств. группа Fm3m; т.пл. 1554°С, т. кип. 2940 °С; плотн. 12,02 г/см3; 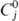 25,8 Дж/моль • К);
25,8 Дж/моль • К); 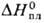 16,7 кДж/моль,
16,7 кДж/моль, 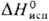 353 кДж/моль;
353 кДж/моль; 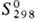 37,65 Дж/моль·К); температурный коэф. линейного расширения 1,17·10-5 К-1 (273-373 К);
37,65 Дж/моль·К); температурный коэф. линейного расширения 1,17·10-5 К-1 (273-373 К); 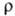 9,96 мкОм • см (25 °С); теплопроводность 75,3 Вт/(м·К); g 0,015 Н/см (при 1554°С в вакууме, палладий 99,998%-ной чистоты); парамагнетик, уд. магн. восприимчивость + 5,231 · 10-б (20 °С); работа выхода электрона 4,99 эВ. Для отожженного палладия модуль упругости 117 ГПа, сг 1,8-2,0 ГПа, относит. удлинение 25-40%; твердость по Виккерсу 37-39. Палладий упрочняется при холодном деформировании, но становится мягче после отжига. Добавки нек-рых в-в, особенно Ru и Ni, повышают твердость. Палладий легко поддается ковке, штамповке, прокатке, протяжке, хорошо полируется и сваривается. Из него удается получать тончайшие листы и тонкую проволоку.
9,96 мкОм • см (25 °С); теплопроводность 75,3 Вт/(м·К); g 0,015 Н/см (при 1554°С в вакууме, палладий 99,998%-ной чистоты); парамагнетик, уд. магн. восприимчивость + 5,231 · 10-б (20 °С); работа выхода электрона 4,99 эВ. Для отожженного палладия модуль упругости 117 ГПа, сг 1,8-2,0 ГПа, относит. удлинение 25-40%; твердость по Виккерсу 37-39. Палладий упрочняется при холодном деформировании, но становится мягче после отжига. Добавки нек-рых в-в, особенно Ru и Ni, повышают твердость. Палладий легко поддается ковке, штамповке, прокатке, протяжке, хорошо полируется и сваривается. Из него удается получать тончайшие листы и тонкую проволоку.
По хим. св-вам палладий близок к платине и является наиб. активным платиновым металлом. При нагр. устойчив на воздухе до ~ 300 °С, при 350-800 °С тускнеет из-за образования тонкой пленки PdO, выше 850 °С PdO разлагается и вновь становится устойчивым на воздухе. Хорошо раств. в царской водке. В отличие от др. платиновых металлов, раств. в горячих конц. HNO3 и H2SO4. Переходит в р-р при анодном растворении в соляной к-те. При комнатной т-ре взаимод. с влажными Сl2 и Вг2, при нагр.-с F2, S, Se, Те, As и Si. Характерная особенность палладия-способность поглощать большие кол-ва Н2 (до 900 объемов на 1 объем палладия) благодаря образованию твердых р-ров с увеличением параметра кристаллич. решетки; предполагается также образование гидридов. Поглощенный Н2 легко удаляется из палладия при нагр. до 100 °С в вакууме. Явления, наблюдаемые при поглощении тяжелого изотопа водорода катодом из палладия в ходе электролиза D2O, принимались за свидетельство, "холодного" ядерного синтеза. Палладий взаимод. с расплавл. KHSО4, с Na2O2.
Черный нерастворимый в воде оксид PdO 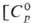 31 ДжДмоль • К),
31 ДжДмоль • К), 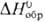 -15 кДж/моль,
-15 кДж/моль, 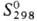 39 ДжДмоль • К)] разлагается на простые в-ва выше 800-850 °С; сильный окислитель. Гидролизом солей Pd(II,III,IV) выделены соотв. черный Pd(OH)2 (
39 ДжДмоль • К)] разлагается на простые в-ва выше 800-850 °С; сильный окислитель. Гидролизом солей Pd(II,III,IV) выделены соотв. черный Pd(OH)2 (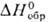 —161,1 кДж/моль), шоколад-но-черный Pd2O3·nH2O и темно-красный PdO2. Оксиды Pd(III,IV)-сильные окислители; при небольшом нагр. разлагаются до PdO.
—161,1 кДж/моль), шоколад-но-черный Pd2O3·nH2O и темно-красный PdO2. Оксиды Pd(III,IV)-сильные окислители; при небольшом нагр. разлагаются до PdO.
Гексафторид PdF6 получают взаимодействием палладия с атомным F, красно-коричневый тетрафторид PdF4-фто-рированием Pd2F6 под давлением F2 при 300-450 °С, черный "три фторид" PdIIPdIVF6 и бледно-фиолетовый д и фторид PdF2 - взаимодействием палладия или его галогенидов с F2. Фториды палладия-сильные окислители, термически неустойчивы и легко гидролизуются водой. Существуют фторопаллада-ты(II и III) состава 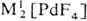 , МI[Рd2F5],
, МI[Рd2F5], 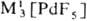 MII[PdF4],
MII[PdF4], 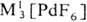 и др. Взаимодействием PdF6 с О2 получен оранжевый гексафторопалладат(V) диоксигенила O2PdF6.
и др. Взаимодействием PdF6 с О2 получен оранжевый гексафторопалладат(V) диоксигенила O2PdF6.
Дихлорид PdCl2-красные кристаллы гексагон. синго-нии (т. пл. 680 °С, 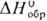 —163 кДж/моль); легко раств. в воде, в соляной к-те, давая тетрахлоропалладие-вую(II) к-ту H2[PdCl4]; получают из простых в-в выше 500 °С. При растворении в царской водке палладий образует гекса-хлоропалладиевую(IV) к-ту H2[PdCl6], разлагающуюся при кипячении до Н2 [PdCl4] и Сl2. Выделены многочисл. хлоропалладаты(IV) M2[PdCl6] и хлоропалладаты(II) M2[PdCl4], а также их производные, св-ва к-рых используют для выделения и аффинажа палладия. Так, в хлоридном р-ре, содержащем NH3, палладий может образовывать плохо р-римый хлоропалладозамин Pd(NH3)2Cl2 (слабокислая среда), нерастворимую соль Вокелена [Pd(NH3)4] [PdCl4] или р-римый дихлорид тетрамминопалладия (II) Pd(NH3)4Cl2 (сильно щелочная среда). Р-р солей Pd2+ сначала сильно подщелачивают, отделяя осадки гидроксидов металлов (примесей), а затем подкисляют, выделяя палладий в осадок. Осадок Pd(NH3)2Cl2 термически разлагают при 800-900 °С до металла.
—163 кДж/моль); легко раств. в воде, в соляной к-те, давая тетрахлоропалладие-вую(II) к-ту H2[PdCl4]; получают из простых в-в выше 500 °С. При растворении в царской водке палладий образует гекса-хлоропалладиевую(IV) к-ту H2[PdCl6], разлагающуюся при кипячении до Н2 [PdCl4] и Сl2. Выделены многочисл. хлоропалладаты(IV) M2[PdCl6] и хлоропалладаты(II) M2[PdCl4], а также их производные, св-ва к-рых используют для выделения и аффинажа палладия. Так, в хлоридном р-ре, содержащем NH3, палладий может образовывать плохо р-римый хлоропалладозамин Pd(NH3)2Cl2 (слабокислая среда), нерастворимую соль Вокелена [Pd(NH3)4] [PdCl4] или р-римый дихлорид тетрамминопалладия (II) Pd(NH3)4Cl2 (сильно щелочная среда). Р-р солей Pd2+ сначала сильно подщелачивают, отделяя осадки гидроксидов металлов (примесей), а затем подкисляют, выделяя палладий в осадок. Осадок Pd(NH3)2Cl2 термически разлагают при 800-900 °С до металла.
Коричневый дибромид PdBr2 (т.пл. 717°С, 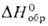 — 120 кДж/моль) плохо раств. в воде, лучше-в бромисто-водородной к-те. Его получают растворением Pd в смеси бромистоводородной к-ты и Вг2. Черный дииодид PdI2 (
— 120 кДж/моль) плохо раств. в воде, лучше-в бромисто-водородной к-те. Его получают растворением Pd в смеси бромистоводородной к-ты и Вг2. Черный дииодид PdI2 (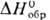 — 63 кДж/моль) не раств. в воде, осаждается из р-ров PdCl2, образует иодопалладаты(II), напр. K2[PdI4].
— 63 кДж/моль) не раств. в воде, осаждается из р-ров PdCl2, образует иодопалладаты(II), напр. K2[PdI4].
Сульфид PdS (т.пл. 970°С, 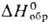 -77,0 кДж/моль), дисульфид PdS2 и др. сульфиды палладия не раств. в воде. Известны селениды PdSe, PdSe2, Pd4Se, теллуриды PdTe, PdTe2, Pd2Te, Pd3Te, Pd5Te2, фосфиды PdP2, Pd3P, Pd5P, Pd5P2, арсениды PdAs, Pd2As, Pd3As, Pd3As2, силициды PdSi, Pd2Si и Pd3Si.
-77,0 кДж/моль), дисульфид PdS2 и др. сульфиды палладия не раств. в воде. Известны селениды PdSe, PdSe2, Pd4Se, теллуриды PdTe, PdTe2, Pd2Te, Pd3Te, Pd5Te2, фосфиды PdP2, Pd3P, Pd5P, Pd5P2, арсениды PdAs, Pd2As, Pd3As, Pd3As2, силициды PdSi, Pd2Si и Pd3Si.
Коричнево-желтый нитрат Pd(NO3)2 хорошо раств. в воде, гидролизуется при кипячении водного р-ра. Выделен темно-красный сульфат PdSO4, его оливково-зеленый моногидрат и красновато-коричневый дигидрат, к-рые легко гидролизуются.
Палладий в степени окисления + 2 образует многочисл. комплексные соед. с лигандами, содержащими "мягкие" доноры: CN-, P(III), As(III) и др. Для Pd(IV) наиб. типичны соед., содержащие ион [PdX6]2- (X = F, Cl, Вг). Известны соединения с нейтральными группами типа Pd(aмин)2X4 и др. Получены комплексные соед. Pd0, напр. [Pd(CN)4]4-, Pd(PF3)4 (т.пл. — 40°С). См. также Палладийорганические соединения.
Получение. Из технол. р-ра благородных металлов в царской водке сначала осаждают Аи и Pt. Затем осаждают Pd(NH3)2Cl2, к-рый очищают перекристаллизацией из аммиачного р-ра НС1, высушивают и прокаливают в восстановит. атмосфере. Порошок палладия переплавляют. Восстановлением р-ров солей палладия получают мелкокристаллический палладий-палладиевую чернь. Электроосаждение палладия проводят из нитритных и фосфатных кислых электролитов, в частности с использованием Na2[Pd(NO2)4].
В сер. 80-х гг. ежегодная добыча палладия в капиталистич. и развивающихся странах составляла 25-30 т. При этом из вторичного сырья получали не более 10% палладия. По оценкам 2/3 мировой добычи палладия падало на СССР.
Применение. По объему годового потребления в капиталистич. и развивающихся странах палладий опережает др. платиновые металлы. Из областей его применения наиб. важны медицина и стоматология (25-40% ежегодного потребления), электротехника и электроника (30-40%), хим. пром-сть (10-15%), автомобилестроение (5-15%), ювелирная (2-5%) и стекольная пром-сть и др.
Из палладия и его сплавов изготовляют мед. инструменты, детали кардиостимуляторов, зубные протезы, оправки, нек-рые лек. ср-ва. В электронике используют, в частности, палладиевые пасты для произ-ва больших интегральных схем, в электротехнике-электрич. контакты из палладия; для этих целей выпускают пружинящие контакты из палладия с добавками Сг и Zr, а также сплавы Pd-Ag и Pd-Cu. Способность палладия растворять Н2 используют для тонкой очистки Н2, каталитич. гидрирования и дегидрирования и др. Обычно для этого используют сплавы с Ag, Rh и др. металлами, а также палладиевую чернь. С сер. 70-х гг. 20 в. палладий в виде сплавов с Pt стали использовать в катализаторах дожигания выхлопных газов автомобилей. В стекольной пром-сти сплавы палладия применяют в тиглях для варки стекла, в фильерах для получения искусств. шелка и вискозной нити.
Палладий открыл У. Волластон в 1803 при исследовании самородной платины.
Лит. см. при ст. Платиновые металлы.
