Малеиновая и фумаровая кислоты
В согласии с выводами стереохимической теории для этилен-1,2-дикарбоновой кислоты возможны две пространственные конфигурации:

Эта кислота действительно существует в двух формах, известных под названиями малеиновой (цис-форма) и фумаровой (транс-форма) кислот. На примере этих кислот сторонники стереохимической гипотезы изомерии этиленовых соединений, а также и противники ее в многочисленном ряде исследований стремились найти доводы за и против этой гипотезы. Поэтому характерные черты взаимных отношений стереоизомерных кислот, а также их отношения к другим веществам, находящимся с ними в близкой генетической связи, наиболее подробно выяснены на этом примере.
Фумаровая кислота содержится во многих растениях; особенно часто она встречается в грибах. Название ее происходит от растения Fumaria officinalis (дымянка). Кроме того, фумаровая кислота получается особым брожением сахаристых веществ под действием Aspergillus fumaricus. Малеиновая кислота в природе не найдена.
Обе кислоты обыкновенно получаются при нагревании яблочной кислоты:
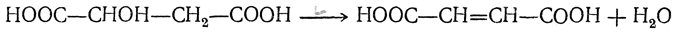
При медленном, осторожном нагревании получается главным образом фумаровая кислота, при более сильном нагревании и при перегонке яблочной кислоты — малеиновая кислота.
Малеиновая кислота часто образуется в результате окисления ненасыщенных циклических соединений, например бензохинона. В промышленном масштабе она может быть получена окислением бензола и нафталина кислородом воздуха в присутствии катализаторов (окись ванадия и др.).
Физические свойства и химические превращения фумаровой и малеиновой кислот являются чрезвычайно типичными для цис-транс-изомерии непредельных соединений. Отношения обеих кислот настолько характерны для этого вида изомерии, что они привели к установлению понятия о «фумароидных» и «малеиноидных» формах этиленовых изомеров.
Взаимные отношения фумаровой и малеиновой кислот чрезвычайно напоминают отношения устойчивых (стабильных) и неустойчивых (лабильных) полиморфных разностей. Устойчивая фумаровая кислота, образующая игольчатые кристаллы, имеет более высокую температуру плавления (в запаянном капилляре 287—288° С) и малую растворимость (растворимость, в воде при 16°С почти 1:150). Неустойчивая малеиновая кислота — ромбические призмы, плавящиеся при 130° С, — весьма легко растворима в воде (при обыкновенной температуре растворимость превышает 1:2).
Неустойчивость малеиновой кислоты проявляется в том, что очень часто вместо малеиновой кислоты из ее производных образуется фумаровая кислота. Так, например, это происходит при выделении кислоты из свинцовой соли малеиновой кислоты и других ее солей с тяжелыми металлами действием сероводорода. Кроме того, в присутствии следов иода (особенно на свету), следов азотистой кислоты и даже просто на свету малеиновая кислота превращается в фумаровую. Однако под действием ультрафиолетовых лучей фумаровая кислота может превращаться в малеиновую, что также характерно для всех неустойчивых соединений этого рода. Кроме того, фумаровая кислота при нагревании медленно отщепляет воду с образованием ангидрида малеиновой кислоты. Лучше происходит образование малеинового ангидрида при нагревании фумаровой кислоты с фосфорным ангидридом.
Характерно для отношений этих кислот также и то, что малеиновая кислота является значительно более сильной кислотой, чем фумаровая. Так, константы электролитической диссоциации первой карбоксильной группы К1=9,3 ∙ 10–4 для фумаровой кислоты и K1=1,17 ∙ 10–2 для малеиновой кислоты. Наоборот, константа диссоциации второй карбоксильной группы для фумаровой кислоты больше, чем для малеиновой, а именно: для фумаровой кислоты K2=2,9 ∙ 10–5, а для малеиновой кислоты K2=2,6 ∙ 10–7.
Химические свойства обеих кислот типичны для кислот, содержащих этиленовую связь в положении 1,2 (α, β) по отношению к карбоксилу. Так, уже амальгама натрия восстанавливает обе кислоты в янтарную кислоту.
Очень легко идет присоединение галоидоводорода, приводящее к образованию одной и той же оптически недеятельной (рацемической,) моногалоидзамещенной янтарной кислоты, например:
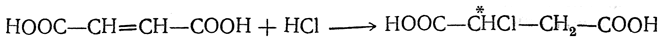
В результате присоединения воды под влиянием катализаторов образуется одна и та же недеятельная (рацемическая) яблочная кислота
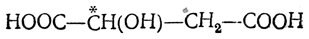
Присоединение двух одинаковых атомов или радикалов, например присоединение молекулы галоида или двух гидроксилов (при окислении перманганатом в щелочной среде), ведет к получению двух стереоизомерных недеятельных предельных соединений (рацемического и мезо-) с двумя асимметрическими атомами углерода, например двух дибромянтарных кислот
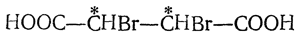
или двух диоксиянтарных (винных) кислот:
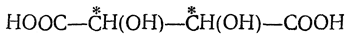
При реакциях присоединения малеиновая кислота в большинстве случаев предварительно частично переходит в фумаровую кислоту. Так, например, при присоединении брома к фумаровой кислоте получается труднорастворимая в воде дибромянтарная кислота, плавящаяся под давлением при 255° С, а из малеиновой кислоты получается легкорастворимая изодибромянтарная кислота с т. пл. 166° С (но также и дибромянтарная кислота вследствие образования фумаровой кислоты). Наоборот, при окислении перманганатом фумаровая кислота дает нормально виноградную кислоту, малеиновая — мезовинную кислоту.
Выбор пространственной конфигурации для малеиновой и фумаровой кислот основан на том, что легкого образования ангидрида можно ожидать лишь от цис-формы, у которой оба карбоксила пространственно близки друг к другу. При окислении циклических соединений, содержащих этиленовые связи, также можно ожидать образования цис-кислоты. На этом основании для малеиновой кислоты становится вероятной цис-конфигураахия, для фумаровой — транс-конфигурация. Это подтверждается отношением фумаровой и малеиновой кислот к винным кислотам.
Казалось бы, указанный выбор конфигураций можно подтвердить и на примере образования дибромянтарных кислот, однако присоединение брома к фумаровой кислоте и к малеиновому ангидриду (сама малеиновая кислота под действием брома изомеризуется в фумаровую) идет не так, как следовало бы ожидать.
Из фумаровой кислоты — безразлично, будет ли атакована двойная связь у (а) или у (б) (рис. 29), — должна была бы получиться рацемическая изодибромянтарная кислота, представляющая собой смесь равных количеств правовращающей и левовращающей кислот. Из малеиновой же кислоты должна получаться дибромянтарная кислота, у которой, как легко видеть, две половины молекулы являются зеркальными изображениями друг друга, и, следовательно, неизбежна полная внутримолекулярная компенсация асимметрии, т. е. должна получаться мезо-форма.
Фактически же при бромировании фумаровой кислоты получается высокоплавящаяся (256° С в запаянном капилляре) дибромянтарная кислота, которая, очевидно, должна быть мезо-формой, а при взаимодействии с бромом малеинового ангидрида (с последующим осторожным омылением) образуется низкоплавящаяся (169° С в открытом капилляре) изодибромянтарная кислота, которую удается разделить в виде солей с цинхонином или морфином на левовращающий и правовращающий изомеры, имеющие т. пл. 157° С. Таким образом из малеиновой кислоты образуется рацемическая смесь антиподов. Это указывает,
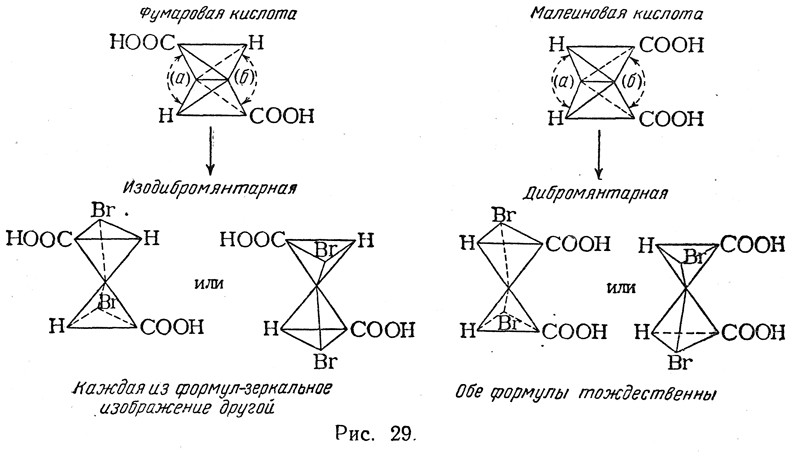
что механизм реакции бромирования сложнее, чем изображено на приведенной схеме. Очевидно, присоединение двух атомов брома происходит или не одновременно (ср. стр. 369), или через переходное состояние, в котором участвуют три молекулы:
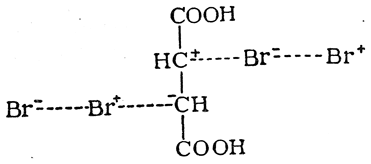
Гидролиз дибромянтарной кислоты дает мезовинную, а гидролиз изодибромянтарной — рацемическую винную кислоту, т. е. при этой реакции перегруппировка не происходит. При отщеплении же от дибромянтарной кислоты молекулы бромистого водорода образуется, по-видимому, броммалеиновая кислота, т. е. цис-кислота, поскольку она легко дает соответствующий ангидрид. Из изодибромянтарной кислоты получается бромфумаровая кислота (рис. 30):
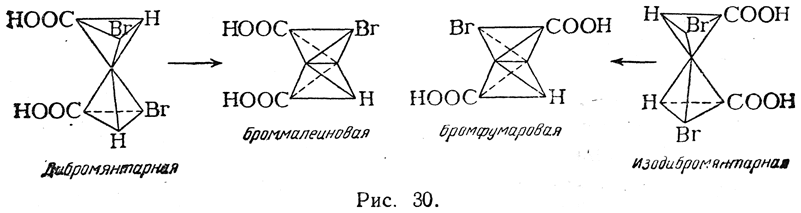
Взаимные отношения бромфумаровой и броммалеиновой кислот напоминают отношения фумаровой и малеиновой кислот. Ангидрид бромфумаровой кислоты (как и фумаровой) неизвестен; в условиях, когда такой ангидрид должен был бы образоваться, получается ангидрид броммалеиновой кислоты Однако при восстановлении обеих кислот цинком и соляной кислотой в водном растворе получается только фумаровая кислота, возможно, вследствие того, что малеиновая кислота в этих условиях может изомеризоваться в фумаровую.
Бромфумаровая кислота при кипячении с водной щелочью гораздо легче отщепляет бромистый водород с образованием ацетилендикарбоновой кислоты, чем броммалеиновая кислота.


