Сурьмаорганические соединения
СУРЬМАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат связь Sb-С. Для сурьмаорганических соединений характерны соед. Sb(III) и Sb(V). Осн. типы соед. Sb(III): R3Sb, R2SbX, RSbX2 (X-остаток минер. или орг. к-ты, Н, OR', SR', NR' металлы I-V групп и др.). Осн. типы соед. Sb(V): R5Sb, R4SbX, R3SbX2, R2SbX3, RSbX4. Известны также оксиды Sb(III) RSbO и (R2Sb)2O, а также Sb(V) R3SbO, арилстибоновые и диарилстибиновые к-ты ArSb(OH)2O и Ar2Sb(OH)O, сурьмаорганические соединения с кратной связью Sb=C, напр, стибабензол (в молекуле бензола один атом С заменен на атом Sb), и сурьмаорганические соединения с кратной связью Sb=Sb, напр. стибино-бензол PhSb=SbPh. В большинстве сурьмаорганических соединений атом Sb имеет координац. числа 3 и 5, однако описаны соед. Sb(III) с коор-динац. числами 2 (напр., стабабензол), 4 (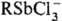 ) и соед. Sb(V) с координац. числами 4 (стибониевые соли R4Sb+X-), 6 ([Ph6Sb]-M+).
) и соед. Sb(V) с координац. числами 4 (стибониевые соли R4Sb+X-), 6 ([Ph6Sb]-M+).
Соединения Sb(III). Соединения Alk3Sb-бесцветно перегоняющиеся жидкости, легко окисляются О2 воздуха (иногда с самовоспламенением), при осторожном окислении образуют R3SbO; устойчивы к действию воды и разбавленных кислот, при реакции с галогенами дают R3SbHal2.
Соед. Аr3Sb-кристаллич. в-ва, устойчивы к влаге и О2 воздуха, при действии к-т легко отщепляют Аr, напр. Ar3Sb + НХ : Ar2SbX + АrН.
Соед. R3Sb, благодаря наличию своб. пары электронов у атома Sb, могут образовывать комплексы, напр. с R'3A1, или служить лигандами в координац. сфере переходного металла. Описано расщепление соед. RR'R:Sb на энантио-меры.
Соед. RnSbX3_n (n = 1,2) легко окисляются и гидролизу-ются с образованием оксидов; при восстановлении дают гидриды RnSbH3_n; гидриды алкилсурьмы чрезвычайно неустойчивы, напр.: CH3SbH2 разлагается при — 80 °С, а (СН3)2SbН-при комнатной т-ре, образуя самовоспламеняющийся на воздухе тетраметилдистибил [(CH3)2Sb]2, гидриды арилсурьмы более устойчивы. При действии щелочных металлов на R2SbHal образуются R2SbM (М = Li, Na), к-рые используют для синтеза сурьмаорганических соединений, содержащих связь Sb с др. металлами, напр. Ph2SbNa + SnCl4 : (Ph2Sb)4Sn. К соед. R2SbM приводят также р-ции R2SbH с RLi или R3Sb с NaNH2. Галогены окисляют R2SbHal и RSbHal2 до R2SbHal3 и RSbHal4.
Оксиды (R2Sb)2O-кpиcтaллич. в-ва мономерной структуры, RSbO - аморфные порошки полимерной структуры; соед. ArSbO неустойчивы и разлагаются по ур-нию: 4ArSbO : (Ar2Sb)2O + Sb2O3.
Осн. методы синтеза R3Sb: 1) взаимод. магний- или ли-тийорг. соед. с SbHal3, в контролируемых условиях можно получить R2SbHal и RSbHal2; в пром-сти используют р-цию алюминийорг. соед. с Sb2O3 и SbF3 либо электролиз алюминийорг. соед. на аноде из Sb; соед., в к-рых R = винил, получают взаимод. ртутьорг. соед. с SbX3; 2) по р-ции Вюрца-Михаэлиса SbCl3 + 6Na + 3PhCl : Ph3Sb + 6NaCl; 3) присоединением гидридов Sb к кетону, алкинам и др.
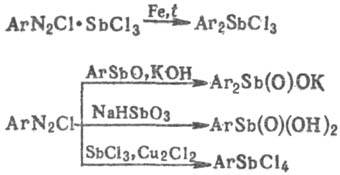
При восстановлении R3SbX2, диарилстибиновых и арил-стибоновых к-т образуются соответственно R3Sb, Ar2SbX и ArSbX2; при разложении R3SbX2 и R2SbX3-соответственно R2SbX и RSbX2; нагревание Sb с RX (R = Alk, Ph, винил) в присутствии Си приводит к смеси R2SbX и RSbX2; р-ция R2SbNa с R'X дает R2SbR'. Для получения ArSbO и Ar2SbX используют разложение двойных диазониевых солей порошком Zn (диазометод Несмеянова), напр.:
ArN2Cl · SbCl3 + Zn + Н2O : ArSbO + N2 + ZnCl2 + 2HCl
[ArN2Cl]2SbCl3 + 2Zn : Ar2SbCl + 2N2 + 2ZnCl2 .
Нек-рые соед. Sb(III) синтезируют с использованием олово- и свинецорг. соед., напр. Ph4Sn + SbCl3 : Ph2SbCl + + Ph2SnCl2.
Соединения Sb(V). Соед. R5Sb-термически устойчивые, перегоняющиеся жидкости (R = низший алкил) либо кристаллич. в-ва (R = арил), быстро разлагающиеся на воздухе. Структура Alk5Sb-тритон. бипирамиды, Ph5Sb и (цикло-C6H11)5Sb-квадратные пирамиды. В р-ре R5Sb легко обменивают орг. радикалы между разл. положениями. При взаимод. R5Sb с разл. электрофилами в мягких условиях отрывается один R и образуются производные типа R4SbX (X = ОН, Hal и др.). Р-ции Ar5Sb с ArLi приводят к ионным комплексам Li[Ar6Sb].
Соед. RnSbX5_n (n = 3,4)-устойчивые кристаллич. в-ва, построенные по ковалентному типу с тригонально-бипира-мид. расположением лигандов. Если Х-бидентатный ли-ганд, то атом Sb из 5-координационного становится 6-коор-динационным. Частичный Гидролиз R3SbHal2 приводит к (R3SbHal)2O, полный гидролиз-к R3SbO. При действии к-т на R3SbO образуются R3SbX2 (Х-остаток минер. или орг. к-ты, SR' и др.). Другие соед. этого типа, такие, как R2SbHal3 и RSbHal4 (R = алкил),-неустойчивы и поэтому практически не изучены. Более устойчивы алкоксипроизвод-ные R2Sb(OR')3, к-рые при р-ции с карбоновыми к-тами образуют R2Sb(OCOR:)3.
Восстановление RnSbX5_n, в отличие от RnSbX3_n, не приводит к гидридам.
Соед., содержащие арильный радикал, устойчивее своих алкильных аналогов. При гидролизе Ar2SbCl3 образуются диарилстибиновые к-ты, при гидролизе ArSbHal4-арилстибоновые к-ты.
Общий метод синтеза R5Sb-взаимод. R3SbX2 с RLi или RMgX. Для получения RnSbCl5_n используют р-цию ацетилена с SbCl5 или галогенсодержащими сурьмаорганическими соединениями, напр.
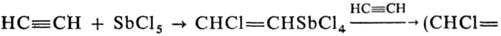
=CH)2SbCl3. При действии НХ на R5Sb образуются R4SbХ, при окислении R3Sb или R2SbHal галогенами соотв. R3SbX2 и R2SbX3.
Арилсодержащие сурьмаорганические соединения получают из диазосоединений по р-циям:
Нек-рые сурьмаорганические соединения [напр., галогениды и оксиды Sb(III)] раздражают кожу и слизистые оболочки.
Сурьмаорганические соединения применяют в качестве лек. препаратов, биоцидов и фунгицидов. Они м.б. использованы как компоненты катализаторов полимеризации, антиоксидантов, добавок к маслам и др.
Лит.: Методы элементоорганической химии. Сурьма, висмут, под ред. А. Н. Несмеянова, К. А. Кочешкова, М., 1976; Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 2, Oxf., 1982, p. 681-707. А. С. Перегудов.
