Нитрометан
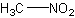
Внешний вид:
бесцветн. жидкостьБрутто-формула (система Хилла): CH3NO2
Формула в виде текста: CH3NO2
Молекулярная масса (в а.е.м.): 61,042
Температура плавления (в °C): -28,55
Температура кипения (в °C): 100,8
Температурные константы смесей:
83,59 °C (температура кипения азеотропа, давление 1 атм) вода 23,6% нитрометан 76,4%
64,33 °C (температура кипения азеотропа, давление 1 атм) метиловый спирт 87,8% нитрометан 12,2%
76 °C (температура кипения азеотропа, давление 1 атм) нитрометан 29% этиловый спирт 71%
Растворимость (в г/100 г или характеристика):
ацетон: растворимвода: растворим 9
диэтиловый эфир: растворим
этанол: растворим
Метод получения 1.
(лабораторный синтез)Источник информации: "Органикум" т.1 М. 1979 стр. 285
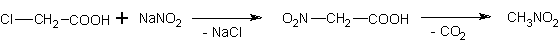
В большом стакане готовят раствор 1,05 моля хлоруксусной кислоты в 200 мл воды, нейтрализуют его содой и прибавляют .раствор 1 моля нитрита натрия в 120 мл воды. В приборе для перегонки (емкость перегонной колбы 500 мл) нагревают 100 мл этого раствора; нагревание можно производить с помощью газовой горелки через проволочную сетку; при этом отгоняется нитрометан. Реакция сопровождается выделением углекислого газа и воды. Через капельную воронку, укрепленную на отводе для термометра, можно добавлять остаток реакционного раствора к горячему раствору в перегонную колбу так, чтобы скорость реакции можно было хорошо контролировать. Перегонку продолжают до тех пор, пока в приемник поступают маслянистые капли, затем заменяют приемник и отгоняют еще 100 мл воды. Нитрометан отделяют из первой фракции, оба водных раствора объединяют, насыщают хлористым натрием и вновь отгоняют около четверти этого раствора. При этом получают еще некоторое количество нитрометана, который также отделяют. После высушивания хлористым кальцием нитрометан перегоняют еще раз.
Выход 20-24 г (33-39%).
Метод получения 2.
(лабораторный синтез)Источник информации: Губен И. "Методы органической химии" т.4 вып.1 М.-Л.:ГНТИХЛ 1949 стр. 313
К раствору 85 г азотистокислого калия (1 моль) в 30 мл воды осторожно прибавляют 126 г (1 моль) диметилсульфата. При частом и сильном взбалтывании реакционная смесь разогревается и вспенивается в результате выделения окислов азота, и поэтому жидкость следует охлаждать водой. По прекращении реакции прибавляют еще 85 г нитрита и смесь сильно взбалтывают до исчезновения слоя диметилеульфата. Продукт перегоняют при атмосферном давлении или в вакууме, причем получают около 50 г дестиллата с темп. кип. 90—100°, содержащего нитрометан в смеси с водой. После высушивания безводным хлористым кальцием остается 30—35 г, т. е. 50—57% от теории, нитрометана, кипящего при 100—101°.
Метод получения 3.
(лабораторный синтез)Источник информации: Губен И. "Методы органической химии" т.4 вып.2 М.-Л.:ГНТИХЛ 1949 стр. 1100-1101
Получение нитрометана по способу Ванга и Тсенга.
К смеси 50 г хлоруксусной кислоты и 100 г льда прибавляют при охлаждении ледяной водой 25 мл 55%-ного раствора едкого натра и одновременно еще 100 г льда, следя за тем, чтобы температура не превышала 10°. Раствор точно нейтрализуют 0,5 N соляной кислотой в присутствии фенолфталеина, прибавляют к нему раствор 36,5 г азотистокислого натрия в 50 мл воды и 37,4 г борной кислоты, после чего смесь нагревают на небольшом пламени в колбе, снабженной погруженным в жидкость термометром и длинным нисходящим холодильником. При 45° начинает выделяться углекислота и небольшое количество окислов азота. Жидкость приобретает зеленую окраску, которая при 80° становится очень интенсивной. При этом начинает отгоняться нитрометан, а зеленая окраска раствора постепенно исчезает. Смесь нагревают до 110°, причем раствор становится оранжево-желтым. Водный слой дистиллята отделяют от нитрометана, прибавляют к нему примерно одну треть по весу хлористого натрия и снова перегоняют, повышая температуру до 110°. Эту операцию повторяют несколько раз. Нитрометан высушивают хлористым кальцием и перегоняют над небольшим количеством окиси ртути. Т. кип. 98—102°.
Выход 18,7 г (58%). В водном дестиллате можно обнаружить лишь очень незначительное количество синильной кислоты. Реакция протекает очень гладко и без вспенивания. При работе с нитрометаном необходимо соблюдать меры предосторожности.
Примечание.
Найдено, что при получении нитрометана из хлоруксусной кислоты и азотистокислого натрия получается только около 50% нитрометана; 24% нитрометана тотчас же после образования превращаются в метазоновую кислоту и продукты конденсации, а остальная хлоруксусная кислота (26%) гидролизуется в гликолевую кислоту и дальше не вступает в реакцию. Добавлением избытка натриевых солей хлоруксусной и гликолевой кислот можно увеличить выход нитрометана до 70% по азотистокислому натрию. В качестве побочного продукта реакции иногда образуется довольно значительное количество синильной кислоты, что требует соблюдения мер предосторожности.
Реакция гидролиза хлоруксусной кислоты до гликолевой может быть частично задержана прибавлением борной кислоты. Выход нитрометана может быть, таким образом, повышен до 58%.
Способы получения:
1. Деструктивное нитрование пропана 50-70% азотной кислотой при 400-700 С в трубке Ni-Cr, в потоке со временем контакта 2 с. (выход 10%)2. Реакцией метилиодида с нитритом серебра в диэтиловом эфире. (выход 71%)
3. Реакцией метилиодида с нитритом натрия в ДМФА.
Плотность:
1,13816 (20°C, г/см3)Показатель преломления (для D-линии натрия):
1,38188 (20°C)Показатель диссоциации:
pKa (1) = 10,21 (25 C, вода)Аналитические
К раствору 0,2 г нитрометана в 10-кратном объеме воды, прибавляют концентрированный раствор нитрита натрия (1:1), охлаждают до 0 С и осторожно прибавляют к нему разбавленную водой серную кислоту (1:1) - образуется метилнитроловая кислота, и затем при охлаждении - концентрированный раствор едкого кали. Появляется красная окраска раствора.
Нагревают 0,5 мл нитрометана и 1 мл 1 н. раствора едкого кали - смесь окрашивается в желтый цвет. Затем прибаляют несколько капель раствора хлорного железа (при этом выпадает осадок гидроокиси железа) и после охлаждения, по каплям, соляную кислоту - смесь окрашивается в кроваво-красный цвет.
Критическая температура (в °C):
314,8Критическое давление (в МПа):
6,31- "Органические реакции" сб.12 М 1965 стр. 156
- "Справочник химика" т.3, Л.-М.: Химия, 1965 стр. 367, 379
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 167
- Юрьев Ю. К. "Практические работы по органической химии" вып.3 2-е изд. М., 1964 стр. 68-69
