Коферменты переноса групп
В данном разделе рассматриваются коферменты, участвующие в реакции переноса групп. Кобамид (кофермент В12) будет рассмотрен на с. 356.
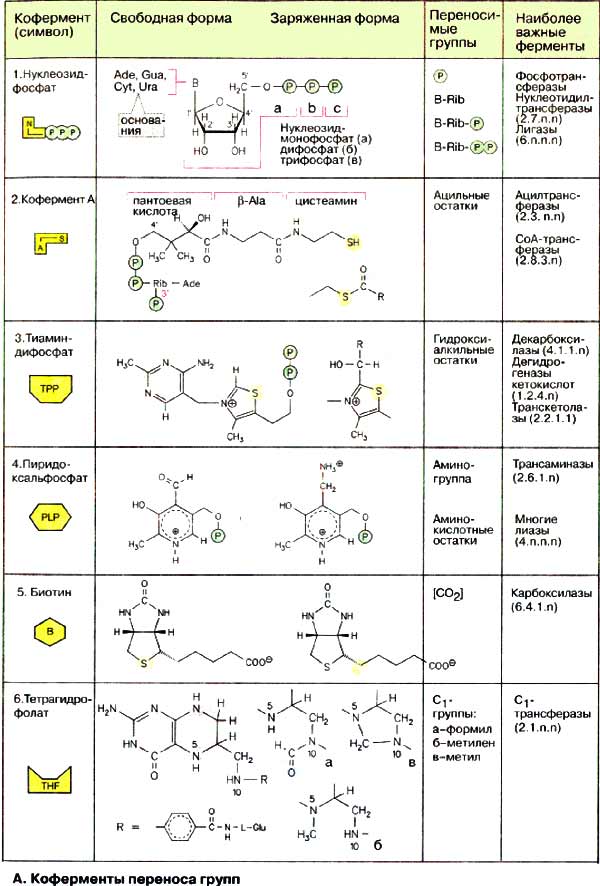
А. Коферменты переноса групп
Нуклеозидфосфаты (1) являются не только исходными соединениями в биосинтезе нуклеиновых кислот, они обладают также функциями коферментов, служат для запасания энергии и участвуют в цепи переноса энергии в эндоэргических процессах. Метаболические интермедиаты часто становятся реакционноспособными («активированными») при присоединении фосфат содержащих остатков (фосфорилирование). Так, присоединение нуклеозиддифосфатных остатков делает реакционноспособными исходные соединения в синтезе полисахаридов и липидов. Лигазы катализируют сшивание соединений за счет энергии нуклеозидтрифосфатов.
Остатки жирных кислот активируются путем переноса на кофермент А (2). В коферменте А пантетеин через фосфоангидридную связь присоединен к 3'-фосфо-АДФ. Пантетеин состоит из трех компонентов, связанных амидными связями: пантоевой кислоты, β-аланина и цистеамина, т. е. двух биогенных аминов, образованных путем декарбоксилирования соответственно аспартата и цистеина. Пантотеновая кислота, образованная из пантоевой кислоты и β-аланина, в организме человека играет роль витамина. При реакции тиоловой группы остатка цистеамина с карбоновой кислотой образуется тиолсложноэфирная связь, как, например, в ацетил-КоА (ацетил-СоА). Эта реакция высоко эндоэргична и поэтому сопряжена с экзоэргическими процессами. Тиоэфир, каким является ацил-КоА, представляет собой активированную форму карбоновой кислоты, так как образующий ее ацильный остаток может легко переноситься на другую молекулу. Этот принцип часто используется при метаболических превращениях.
Тиаминдифосфат (TPP, 3) активирует альдегиды и кетоны и переносит их в виде гидроксиалкильных групп на другую молекулу. Этот способ переноса важен, например, в транскетолазной реакции. Гидроксиалкильные остатки участвуют также в декарбоксилировании кетокислот. Они либо высвобождаются в виде альдегидов, либо переносятся на липоамидные остатки, как в случае дегидрогеназ 2-кетокислот.
Пиридоксальфосфат (PLP) (4) — наиболее важный кофермент в метаболизме аминокислот, его роль при трансаминировании будет подробно рассмотрена на с. 180. Пиридоксальфосфат принимает участие и в других реакциях аминокислот, таких, как декарбоксилирование и дегидратирование. Представленная здесь альдегидная форма в свободном виде не встречается. В отсутствие субстрата альдегидная группа связана с аминогруппой лизинового остатка фермента в виде альдимина («шиффово основание»).
Карбоксилазы содержат в качестве кофермента биотин (5). Он связан амидной связью с боковой цепью лизинового остатка фермента. Биотин реагирует с гидрокарбонатом (НСО3-) в присутствии АТФ с образованием N-карбоксибиотина. Эта активированная форма диоксида углерода может быть перенесена на другую молекулу. Примерами биотинзависимых реакций являются образование оксалоацетата из пирувата и синтез малонил-КоА из ацетил-КоА.
Тетрагидрофолат [ТГФ (THF), 6] является коферментом, который может переносить C1-остатки в различных состояниях окисления. ТГФ образуется из витамина фолиевой кислоты двойным гидрированием птеринового кольца. C1-фрагменты присоединяются к N-5, N-10 или к обоим атомам азота. Наиболее важными производными тетрагидрофолата являются:
а) N10-формил-ТГФ, в котором C1-остаток находится в виде карбоксильной группы,
б) N5, N10-метилен-ТГФ, в котором C1-остаток находится в виде альдегида и
в) N5-метил-THF, где C1 находится в виде спирта.
Переносимый ТГФ C1-фрагмент играет важную роль, например, в синтезе пуриновых нуклеотидов, дезокситимидинмонофосфата и метионина.


