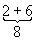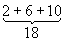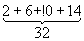Атом
Атом (от греч. atomos — неделимый), частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств. Каждому элементу соответствует определённый род атомов, обозначаемых символом элемента (например, атом водорода Н: атом железа Fe; атом ртути Hg; атом урана U).
Атомы могут существовать как в свободном состоянии, в газе, так и в связанном. Соединяясь химически с атомами того же элемента или атомами других элементов, они образуют более сложные микрочастицы — молекулы, всё огромное многообразие химических соединений обусловлено различными сочетаниями атомов в молекулах. Связываясь друг с другом непосредственно или в составе молекул, атомы образуют жидкости и твёрдые тела.
Свойства макроскопических тел — газообразных, жидких и твёрдых — и свойства отдельных молекул зависят от свойств входящих в их состав атомов. Все свойства атома, физические и химические, определяются его строением как системы, состоящей из ядра и электронов, и подчиняются характерным для микроскопических явлений квантовым законам. Ниже излагаются современные представления о строении и свойствах атома (историю развития учения об атоме см. в ст. Атомная физика).
Общая характеристика строения атома. Атом состоит из тяжёлого ядра, обладающего положительным электрическим зарядом, и окружающих его лёгких электронов с отрицательными электрическими зарядами, образующих электронные оболочки атома. Размеры атома в целом определяются размерами его электронной оболочки и велики по сравнению с размерами ядра атома.
Характерные порядки размеров:
|
| Линейные размеры | Площадь* | Объем |
| Атом | 10—8 см | 10—16 см2 | 10—24 см3 |
| Ядро | 10—12 см | 10—24 см2 | 10—36 см3 |
| Отношение | 104 | 108 | 1012 |
* Поперечное сечение.
Электронные оболочки атомов не имеют строго определённой границы; значения размеров атомов в большей или меньшей степени зависят от способов их определения и весьма разнообразны (см. Атомные радиусы).
Заряд ядра — основная характеристика атома, обусловливающая его принадлежность определённому элементу. Заряд ядра всегда является целым кратным элементарного положительного электрич. заряда е, равного по абсолютному значению заряду электрона —е. Заряд ядра равен +Ze, где Z — порядковый номер (атомный номер). Z = 1, 2, 3, 4,... для атомов последовательных элементов в периодической системе элементов Менделеева, т. е. для атомов Н, Не, Li, Be, ...В нейтральном атоме ядро с зарядом +Ze удерживает Z электронов с общим зарядом —Ze и полный заряд атома равен нулю; в положительном ионе — атоме, потерявшем k электронов (ионизованном атоме), остаётся Z—k электронов (k = 1, 2, 3, ... — кратность ионизации) и его заряд равен +ke, в отрицательном ионе — атоме, присоединившем k электронов,— содержится Z + k электронов, и его заряд равен —ke. Для положительного иона максимальное значение k = Z (такой ион потерял все свои электроны и состоит из «голого» ядра); для отрицательного свободного иона k = 1, для связанных атомов возможно образование отрицательных ионов с k > 1 (в растворах, комплексных соединениях и ионных кристаллах). Говоря об атомах определённого элемента, подразумевают как нейтральные атомы, так и ионы этого элемента. Но иногда под атомом понимают нейтральный атом, в противоположность ионам. Положительные и отрицательные ионы при написании отличают от нейтрального атома индексом k+ и k—, например О обозначает нейтральный атом кислорода (Z = 8), О+, О2+(или O++), O3+,..., O8+ — его положительные ионы,О—, O2— (или О— — его отрицательные ионы. Совокупность нейтрального атома и ионов других элементов с тем же числом электронов образует изоэлектронный ряд. Простейший такой ряд начинается с атома водорода: H, He+, Li2+, Be3+, ...; члены этого ряда состоят из ядра и одного электрона.
Порядок значений зарядов ядер различных атомов был определён английским физиком Э. Резерфордом в его первоначальных опытах по рассеянию альфа-частиц (1911). Значения Z были надёжно установлены английским физиком Г. Мозли (1913—14) на основе изучения рентгеновских спектров последовательных элементов в периодической системе. Кратность заряда ядра атома элементарному заряду е получила объяснение, исходя из представлений о строении ядра: Z равно числу протонов в ядре, протон имеет заряд +е, и полный заряд ядра равен сумме зарядов всех Z протонов, т. е. +Ze.
Масса атома возрастает с увеличением Z. Масса ядра атома приближённо пропорциональна массовому числу А — общему числу протонов и нейтронов в ядре. Масса электрона (0,91 10—27 г) значительно меньше (примерно в 1840 раз) массы протона или нейтрона (1,67 10—24 г), и поэтому масса атома в целом определяется в основном массой его ядра.
Атомы данного элемента могут отличаться массой ядра (число протонов Z постоянно, число нейтронов А—Z может меняться); такие разновидности атомов одного и того же элемента называются изотопами. Различие массы ядра почти не сказывается на строении их электронных оболочек, зависящем от заряда ядра Z. Химические и большинство физических свойств (оптические, электрические, магнитные), определяемые строением электронных оболочек, одинаковы или очень близки для всех изотопов данною элемента. Наибольшие отличия в свойствах (изотонические эффекты) получаются для изотопов водорода (Z = 1) из-за большой разницы в массах обычного лёгкого атома водорода (А = 1), атома дейтерия (А = 2) и атома трития (А = 3).
Масса атома приближённо равна массовому числу А и изменяется от 1,67 10—24 г для самого лёгкого атома водорода (основного изотопа: Z = 1, A = 1) до примерно 4 10—22 г для самых тяжёлых атомов трансурановых элементов (Z = 100, А = 250).
Наиболее точные значения масс атомов могут быть определены методами масс-спектроскопии. Масса атома не равна в точности сумме массы ядра и масс электронов, а несколько меньше — на дефект массы DМ = W/c2', где W — энергия образования атома из ядра и электронов, а с — скорость света. Эта поправка — порядка массы одного электрона mе для тяжёлых атомов, а для лёгких атомов пренебрежимо мала (порядка 10—4 массы электрона).
Энергия атома и её квантование. Благодаря малым размерам и большой массе ядра его можно приближённо считать точечным и покоящимся в центре масс атома (общий центр масс ядра и электронов находится вблизи ядра, а скорость движения ядра относительно центра масс атома мала по сравнению со скоростями движения электронов). Соответственно атом можно рассматривать как систему, в которой N электронов с зарядами —е движутся вокруг неподвижного притягивающего центра. Движение электронов в атоме происходит в ограниченном объёме — оно является связанным. Полная внутренняя энергия атома Е равна сумме кинетических энергий всех электронов Т и потенциальной энергии U — энергии притяжения их ядром и отталкивания их друг от друга (электростатической энергии взаимодействия электрических зарядов ядра и электронов, согласно закону Кулона).
В простейшем случае атома водорода один электрон с зарядом —е движется вокруг неподвижного центра с зарядом +е. В этом случае, согласно классической механике, кинетическая энергия
Т =1/2mv =p2/2m (1)
где m — масса, v — скорость, p = mv — количество движения (импульс) электрона. Потенциальная энергия (сводящаяся к энергии притяжения электрона ядром)
U = U(r) = —e2/r (2)
и зависит только от расстояния r электрона от ядра. Графически функция U(r) изображается кривой (рис. 1, а), неограниченно убывающей при уменьшении r, т. е. при приближении электрона к ядру. Значение U (r) на бесконечности принято за нуль. При отрицательных значениях полной энергии Е = Т + U < 0 движение электрона является связанным: оно ограничено в пространстве значениями r = rmax, при которых Т = 0, Е = U(rmax). При положительных значениях полной энергии E = T + U > 0 движение электрона является свободным — он может уйти на бесконечность с энергией Е = Т = 1/2 mv2, что соответствует ионизованному атому водорода Н+. Нейтральный атом водорода Н представляет, т. о., систему, состоящую из ядра и электрона в связанном состоянии с энергией E < 0.
Полная внутренняя энергия атома Е является его основной характеристикой как квантовой системы — системы, подчиняющейся квантовым законам (см. Квантовая механика). Как показывает огромный экспериментальный материал (см., например, Франка—Герца опыт), атом может длительно находиться лишь в состояниях с определённой энергией — стационарных (неизменных во времени) состояниях.
Существование стационарных состояний — один из основных законов физики микроскопических явлений — квантовой физики. Внутренняя энергия квантовой системы, состоящей из связанных микрочастиц (такой системой и является атом), может принимать одно из дискретного (прерывного) ряда значений
E1, E2, E3, ...(E1 < E2 < E3 < ...). (3)
Каждому из этих «дозволенных» значений энергии соответствует одно или несколько стационарных квантовых состояний движения. Промежуточными значениями энергии (например, лежащими между E1 и E2, E2 и E3 и т.д.) система обладать не может, о такой системе говорят, что её энергия квантована, а нахождение возможных значений энергии называется квантованием энергии. Любое изменение энергии Е связано с квантовым (скачкообразным) переходом системы из одного стационарного квантового состояния в другое (см. ниже).
Графически возможные дискретные значения энергии (3) атома можно изобразить, по аналогии с потенциальной энергией тела, поднятого на различные высоты (на различные уровни), в виде схемы уровней энергии, где каждому значению энергии соответствует прямая, проведённая на высоте Ei (i = 1, 2, 3, ...); такая схема приведена на рис. 1, б для атома водорода (на рис. 1, а при E < 0 оказываются, т. о., возможными лишь определённые ступеньки, соединённые горизонтальным пунктиром с уровнями схемы на рис. 1, б). Самый нижний уровень Ei, соответствующий наименьшей возможной энергии системы, называется основным, а все остальные (Ei > Ei, г = 2, 3, 4, ...) — возбуждёнными, т. к. для перехода на них (перехода в соответствующие стационарные возбуждённые состояния из стационарного основного состояния) необходимо возбудить систему — сообщить ей извне энергию Ei—E1.
Квантование энергии атома является следствием волновых свойств электронов. Нельзя считать, что электрон в атоме движется как материальная точка по определённой траектории, согласно законам классической механики. Эти законы справедливы лишь для частиц большой массы (макрочастиц), а для электрона, как микрочастицы, необходимо учитывать, наряду с его корпускулярными свойствами (свойствами частицы), и его волновые свойства. Согласно квантовой механике, движению микрочастицы массы m со скоростью v соответствует длина волны l = h/mv, где h — Планка постоянная. Для электрона в атоме l ~ 10—8 см, т. е. порядка линейных размеров атома, и учёт волновых свойств электрона в атоме является необходимым. Связанное движение электрона в атоме схоже со стоячей волной, и его следует рассматривать не как движение материальной точки по траектории, а как сложный колебательный процесс. Для стоячей волны в ограниченном объёме возможны лишь определённые значения длины волны l (и, следовательно, частоты колебаний v). Так как, согласно квантовой механике, v = E/h, отсюда следует, что система, состоящая, подобно атому, из связанных микрочастиц, может иметь лишь определённые значения энергии, т. е. энергия квантуется и получается дискретная последовательность уровней энергии — дискретный энергетический спектр. Для атома водорода такая дискретная последовательность получается при Е < 0 (см. рис. 1). Свободное, т. е. не ограниченное в пространстве, поступательное движение микрочастицы, например движение электрона, оторванного от атома (в случае атома водорода — электрона с энергией Е > 0), сходно с распространением бегущей волны в неограниченном объёме, для которой возможны любые значения l (и v). Энергия такой свободной микрочастицы может принимать любые значения, т. е. не квантуется, и получается непрерывная последовательность уровней энергии — непрерывный энергетический спектр. Для атома водорода такая непрерывная последовательность, соответствующая ионизованному атому, получается при E > 0. Значение Е ¥ = 0 соответствует границе ионизации, а разность Е ¥ — Е1 = Еион представляет энергию ионизации: для атома водорода она равна 13,6 эв.
Распределение электронной плотности. Состояние электрона в атоме можно характеризовать распределением в пространстве его электрического заряда с некоторой плотностью — распределением электронной плотности. При этом электроны рассматриваются наглядным образом, как «размазанные» в пространстве и образующие «электронное облако». Такая модель правильнее характеризует электроны в атоме, чем модель точечного электрона, движущегося, согласно теории Бора (см. Атомная физика), по строго определённым орбитам. Вместе с тем боровским орбитам можно сопоставить определённые распределения электронной плотности. Для основного уровня энергии Е1 электронная плотность концентрируется вблизи ядра; для возбуждённых уровней энергии E2, E3, E4,... она распределяется на всё больших средних расстояниях от ядра (что соответствует возрастанию размера орбит в теории Бора). В сложном атоме эти электроны группируются в оболочки, окружающие ядро на различных расстояниях и характеризующиеся определёнными распределениями электронной плотности. Прочность связи электронов в более внешних оболочках меньше, чем во внутренних, и слабее всего электроны связаны в самой внешней оболочке, обладающей наибольшими размерами, которые и определяют размеры атома в целом. При ионизации атом теряет внешние электроны; размеры положительных ионов тем меньше размеров нейтрального атома, чем выше кратность иона. Наоборот, размеры отрицательных ионов больше размеров нейтрального атома.
Учёт спина электрона и спина ядра. В теории атома весьма существен учёт спина электрона — его собственного (спинового) момента количества движения, с наглядной точки зрения соответствующего вращению электрона вокруг собственной оси (если электрон рассматривать как частицу малых размеров). Со спином электрона связан его магнитный момент. Поэтому в атоме необходимо учитывать, наряду с электростатическими взаимодействиями (см. выше), и магнитные взаимодействия, определяемые спиновым магнитным моментом, а также орбитальным магнитным моментом, связанным с движением электрона вокруг ядра; магнитные взаимодействия малы по сравнению с электростатическими. Наиболее существенное влияние спина проявляется в сложных атомах: от спина электронов зависит заполнение электронных оболочек атома определённым числом электронов (см. ниже).
Ядро в атоме также может обладать собственным механическим моментом — ядерным спином, с которым связан небольшой ядерный магнитный момент (в сотни и тысячи раз меньший электронного магнитного момента), а в некоторых случаях и т. н. квадрупольный электрический момент (см. Моменты атомных ядер). Это приводит к дополнительным очень малым взаимодействиям ядра и электронов, обусловливающим дополнительное расщепление уровней энергии атома — т. н. сверхтонкую структуру (малую по сравнению с тонкой структурой).
Квантовые состояния атома водорода. Важнейшую роль в квантовой теории атома играет теория простейшего одноэлектронного атома, состоящего из ядра с зарядом +Ze и электрона с зарядом —е, — теория атома водорода Н и водородоподобных ионов Не+, Li2+, Ве3+,... (изоэлектронного ряда, см. выше), называется обычно теорией атома водорода. Методами квантовой механики можно получить точную и полную характеристику состояний электрона в одноэлектронном атоме. Задача о сложных (многоэлектронных) атомах решается лишь приближённо; при этом исходят из результатов решения задачи об одноэлектронном атоме.
Уровни энергии атома водорода и водородоподобных ионов. Энергия одноэлектронного атома (без учёта спина электрона) равна
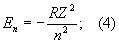
целое число n = 1, 2, 3, ... определяет возможные дискретные значения энергии — уровни энергии; его называют главным квантовым числом. R — Ридберга постоянная, равная 13,6 эв. Уровни энергии атома водорода на схеме рис. 1, б построены для Z = 1 согласно формуле (4); они сгущаются (сходятся) к границе ионизации Е¥ = 0, соответствующей n = ¥ (уровни энергии с n > 5 на схеме не показаны). Для водородоподобных ионов изменяется (в Z2 раз) лишь масштаб энергий. Энергия ионизации водородоподобного атома (энергия связи электрона в таком атоме) равна (в эв)
Еион = E¥ — E1 = RZ2 = 13,6Z2 (5)
что даёт для Н, Не+, Li2+, ... значения 13,6 эв, 54,4 эв, 122,4 эв, ...
Основная формула (4) соответствует выражению U (r) = —Ze2/r для потенциальной энергии электрона, притягиваемого ядром с зарядом +Ze [см. (2) и рис. 1, а для случая Z = 1]. Эта формула была впервые выведена Н. Бором в его теории атома (1913) путём рассмотрения движения электрона вокруг ядра по круговой орбите радиуса r. Уровням энергии (4) соответствуют орбиты радиуса
anZ = a0n2/Z (6)
где постоянная a0 = 0,529 10—8см = 0,529 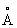 — радиус первой круговой орбиты атома водорода, соответствующей его основному уровню (этим боровским радиусом часто пользуются в качестве удобной единицы для измерений длин в атомной физике). Радиус орбит пропорционален квадрату главного квантового числа n2 и обратно пропорционален Z; для водородоподобных ионов масштаб линейных размеров уменьшается в Z раз по сравнению с атомом водорода.
— радиус первой круговой орбиты атома водорода, соответствующей его основному уровню (этим боровским радиусом часто пользуются в качестве удобной единицы для измерений длин в атомной физике). Радиус орбит пропорционален квадрату главного квантового числа n2 и обратно пропорционален Z; для водородоподобных ионов масштаб линейных размеров уменьшается в Z раз по сравнению с атомом водорода.
Характеристика квантовых состояний атома водорода. Согласно квантовой механике, состояние атома водорода полностью определяется дискретными значениями четырёх физических величин: энергии Е, орбитального момента Ml, (момента количества движения электрона относительно ядра); проекции Mlz орбитального момента на направление z (выбранное произвольно в пространстве); проекции Msz спинового момента (собственного момента количества движения электрона Ms). Возможные значения этих физических величин, в свою очередь, определяются соответствующими квантовыми числами:
1) Е — по закону (4) — главным квантовым числом n =1, 2, 3, ...;
2) Мl — по закону Ml2 = (h2/4p2)l(l + 1) [при l " 1, Ml2 = (h2/4p2)l2 — орбитальным (или азимутальным) квантовым числом l = 0,1, 2, ..., n—1;
3) Mlz — по закону Mlz = (h/2p)mlz — магнитным орбитальным квантовым числом ml = l, l—1, ..., —l;
4) Msz — по закону Msz = (h/2p)ms — магнитным спиновым квантовым числом ms = 1/2, —1/2.
Значения квантовых чисел n, l, ml, ms и характеризуют состояние электрона в атоме водорода. Энергия атома водорода зависит только от n, и уровню энергии с заданным n соответствует ряд состояний, отличающихся значениями l, ml и ms. Состояния с заданными значениями n и l принято обозначать как 1s, 2s, 2p, 3s, ..., где цифры указывают значение n, а буквы s, р, d, f (дальше по латинскому алфавиту) — соответственно значения l = 0, 1, 2, 3, ... При заданных n и l число различных состояний равно 2(2l + 1) — числу комбинаций значений ml и ms (первое принимает 2l + 1 значение, второе — 2 значения). Общее число различных состояний с заданными n и l при учёте, что l может принимать значения от 0 до n—1, получается равным
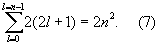
Т. о., каждому уровню энергии атома водорода соответствует 2, 8, 18, ..., 2n2 (при n = 1, 2, 3, ...) различных стационарных квантовых состояний (рис. 2). Если уровню энергии соответствует лишь одно квантовое состояние, то его называют невырожденным, если два или более — вырожденным (см. Вырождение), а число таких состояний g называются степенью или кратностью вырождения (для невырожденных уровней энергии g = 1). Уровни энергии атома водорода являются вырожденными, а их степень вырождения gn = 2n2.
Для различных состояний атома водорода получается и различное распределение электронной плотности. Оно зависит от квантовых чисел n, l и /mi/. При этом электронная плотность для s-cocтояний (l = 0) отлична от нуля в центре, т. е. в месте нахождения ядра, и не зависит от направления (сферически симметрична), а для остальных состояний (l > 0) она равна нулю в центре и зависит от направления. Распределение электронной плотности для состояний атома водорода с n = 1, 2 и 3 показано на рис. 3 (оно получено фотографированием специальных моделей); размеры «электронного облака» растут примерно пропорционально n2(масштаб на рис. 3 уменьшается при переходе от n = 1 к n = 2 и от n = 2 к n = 3), что соответствует увеличению радиуса орбит по формуле (6) в теории Бора.
Квантовые состояния электрона в водородоподобных ионах характеризуются теми же четырьмя квантовыми числами n, l, ml и ms, что и в атоме водорода. Сохраняется и распределение электронной плотности, только она увеличивается в Z раз и на рис. 3 масштабы нужно уменьшить также в Z раз. Соответственно уменьшаются и размеры орбит.
Действие внешних полей на уровни энергии атома водорода. Во внешнем электрическом и магнитном полях атом как электрическая система приобретает дополнительную энергию. Электрическое поле поляризует атом — смещает электронное облако относительно ядра, а магнитное поле ориентирует определённым образом магнитный момент атома, связанный с движением электрона вокруг ядра (с орбитальным моментом Ml) и его спином. Различным состояниям атома водорода с той же энергией Еn во внешнем поле соответствует различная дополнительная энергия DE и вырожденный уровень энергии Еn расщепляется на ряд подуровней (рис. 4). Как расщепление в электрическом поле — Штарка явление, так и расщепление в магнитном поле — Зеемана явление, для уровней энергии атома водорода пропорциональны напряжённости полей.
К расщеплению уровней энергии приводят и малые магнитные взаимодействия внутри атома. Для атома водорода и водородоподобных ионов имеет место спин-орбитальное взаимодействие — взаимодействие спинового и орбитального моментов электрона, не учитываемое при выводе основной формулы (4); оно обусловливает т.н. тонкую структуру уровней энергии — расщепление возбуждённых уровней Еn (при n > 1) на подуровни. Наиболее точные исследования тонкой структуры методами радиоспектроскопии показали наличие т. н. сдвига уровней, объясняемого в квантовой электродинамике.
Для всех уровней энергии атома водорода наблюдается и сверхтонкая структура, обусловленная очень малыми магнитными взаимодействиями ядерного спина с электронными моментами. Уровень E1 расщепляется на 2 подуровня с расстоянием между ними примерно 5 10—6 эв.
Электронные оболочки сложных атомов. Теория сложных атомов, содержащих 2 или более электронов, принципиально отличается от теории атома водорода, т. к. в сложном атоме имеются взаимодействующие друг с другом одинаковые частицы — электроны. Взаимное отталкивание электронов в многоэлектронном атоме существенно уменьшает прочность их связи с ядром. Например, энергия отрыва единственного электрона в ионе гелия (Не+) равна 54,4 эв, в нейтральном же атоме гелия в результате отталкивания электронов энергия отрыва одного из них уменьшается до 24,6 эв. Для внешних электронов более тяжёлых атомов уменьшение прочности их связи из-за отталкивания внутренними электронами ещё более значительно. Чрезвычайно важную роль в сложных атомах играют свойства электронов как одинаковых микрочастиц (см. Тождественности принцип), обладающих спином s = 1/2, для которых справедлив Паули принцип. Согласно этому принципу, в системе электронов не может быть более одного электрона в каждом квантовом состоянии, что для сложного атома приводит к образованию электронных оболочек, заполняющихся строго определёнными числами электронов.
Учитывая неразличимость взаимодействующих между собой электронов, имеет смысл говорить только о квантовых состояниях атома в целом. Однако приближённо можно рассматривать квантовые состояния отдельных электронов и характеризовать каждый из них совокупностью четырёх квантовых чисел n, l, ml и ms, аналогично электрону в атоме водорода. При этом энергия электрона оказывается зависящей не только от n, как в атоме водорода, но и от l; от ml; и ms она по-прежнему не зависит. Электроны с данными n и l в сложном атоме имеют одинаковую энергию и образуют определённую электронную оболочку; их называют эквивалентными электронами. Такие электроны и образованные ими оболочки обозначают, как и квантовые состояния и уровни энергии с заданными n и l, символами ns, nр, nd, nf, ... (для l = 0, 1, 2, 3 ....) и говорят о 2р-электронах, 3s-oболочках и т. п.
Заполнение электронных оболочек и слоёв. В силу принципа Паули любые 2 электрона в атоме должны находиться в различных квантовых состояниях и, следовательно, отличаться хотя бы одним из четырёх квантовых чисел n, l, ml и ms. Для эквивалентных электронов (n и l одинаковы) должны быть различны пары значений mi и ms. Число таких пар равно числу различных квантовых состояний электрона с заданными n иl, т. е. степени вырождения его уровня энергии. Это число gl = 2 (2l + 1) = 2, 6, 10, 14, ... и определяет число электронов, полностью заполняющих данную оболочку. Т. о., s-, р-, d-, f-, ... оболочки заполняются 2, 6, 10, 14, ... электронами, независимо от значения n. Электроны с данным n образуют слой, состоящий из оболочек с l = 0, 1, 2, ..., n—1 и заполняемый 2n2 электронами, т. н. К-, L-, М-, N-, ...слой. При полном заполнении имеем:
| n | 1 | 2 | 3 | 4 |
| Слои | К-слой | L-слой | M-слой | N-слой |
| l | 0 | 0 1 | 0 1 2 | 0 1 2 3 |
| Оболочки | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| Число электронов в слое | 2 |
|
|
|
Наиболее близко к ядру расположен К-слой, затем идёт L-cлой, М-слой, N-cлой, ... В каждом слое оболочки с меньшими l характеризуются большей электронной плотностью вблизи ядра. Прочность связи электрона уменьшается с увеличением n, а при заданном n — с увеличением l; на рис. 5 схематически показаны (без соблюдения масштаба энергий) уровни энергии отдельного электрона в сложном атоме. Чем слабее связан электрон в соответствующей оболочке, тем выше лежит его уровень энергии. Ядро с заданным Z присоединяет электроны в порядке уменьшения прочности их связи: сначала два электрона 1s, затем два электрона 2s, шесть электронов 2p и т. д. в соответствии со схемой рис. 5. Это определяет электронные конфигурации, т. е. распределения электронов по оболочкам, для ионов и нейтрального атома данного элемента. Например, для азота (Z = 7) получаются электронные конфигурации
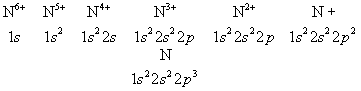
(число электронов в данной оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и ионы азота, имеют нейтральные атомы последовательных элементов в периодической системе, обладающие тем же числом электронов: Н, Не, Li, Be, В, С (Z = 1,2,3,4,5,6). Периодичность в свойствах элементов определяется сходством внешних электронных оболочек атомов. Например, нейтральные атомы Р, As, Sb, Bi (Z = 15, 33, 51, 83) имеют по три р-электрона во внешней электронной оболочке подобно атому N и схожи с ним по химическим и многим физическим свойствам.
При рассмотрении заполнения электронных оболочек необходимо учитывать, что, начиная с n = 4, электроны с меньшим l, но большим n, связываются прочнее, чем электроны с большим l, но меньшим n, например электроны 4s связаны прочнее, чем электроны 3d. Это отражает рис. 5, показывающий расположение уровней энергии, соответствующее действительному порядку (несколько схематизированному) заполнения электронных оболочек для последовательных элементов в периодической системе элементов Д. И. Менделеева. Числа, стоящие справа у скобок, определяют числа элементов в периодах этой системы, заканчивающихся атомами инертных газов с внешними оболочками типа nр6 (n = 2, 3, 4, 5, 6) для Ne, Ar, Kr, Xe, Rn (Z = 10, 18, 36, 54, 86).
Уровни энергии сложных атомов. Каждый атом характеризуется нормальной электронной конфигурацией, получающейся, когда все электроны в атоме связываются наиболее прочно, и возбуждёнными электронными конфигурациями, когда один или несколько электронов связаны более слабо — находятся на более высоких уровнях энергии. Например, для атома гелия наряду с нормальной электронной конфигурацией 1s2 возможны возбуждённые: 1s 2s, 1s 2p, ... (возбуждён один электрон), 2s'2, 2s2p, ... (возбуждены оба электрона). Определённой электронной конфигурации соответствует один уровень энергии атома в целом, если электронные оболочки целиком заполнены (например, нормальная конфигурация атома Ne 1s2 2s2 2p6), и ряд уровней энергии, если имеются частично заполненные оболочки (например, нормальная конфигурация атома N 1s2 2s2 2p3, для которой оболочка 2p заполнена как раз наполовину). При наличии частично заполненных d- и f-oболочек число уровней энергии, соответствующих каждой конфигурации, может достигать многих сотен, так что схема уровней энергии атома с частично заполненными внешними оболочками получается очень сложной. Основным уровнем энергии атома является самый нижний уровень нормальной электронной конфигурации.
Квантовые переходы в атоме. При квантовых переходах атом переходит из одного стационарного состояния в другое — с одного уровня энергии на другой. При переходе с более высокого уровня энергии Ei на более низкий Ek атом отдаёт энергию Ei—Ek, при обратном переходе получает её. Как для любой квантовой системы, для атома квантовые переходы могут быть двух типов: с излучением (оптические переходы) и без излучения (безызлучательные или неоптические переходы). Важнейшая характеристика квантового перехода — вероятность перехода, определяющая, как часто этот переход будет происходить.
Квантовые переходы с излучением. При этих переходах атом поглощает (переход Ek ® Ei) или испускает (переход EI ® Ek) электромагнитное излучение, например видимый свет, ультрафиолетовые лучи, инфракрасные лучи, СВЧ (микроволновое) излучение. Электромагнитная энергия поглощается и испускается атомом в виде кванта света — фотона, характеризуемого определённой частотой колебаний v, согласно соотношению:
Ei—Ek = hv, (8)
где h — постоянная Планка; hv — энергия фотона. Закон (8) представляет собой закон сохранения энергии для микроскопических процессов, связанных с излучением.
Атом в основном состоянии может только поглощать фотоны, а атом в возбуждённых состояниях может как поглощать, так и испускать их. Свободный атом в основном состоянии может существовать неограниченно долго; продолжительность пребывания атома в возбуждённом состоянии — время жизни на возбуждённом уровне энергии — ограничена, атом спонтанно, т. е. самопроизвольно, частично или полностью теряет энергию возбуждения, испуская фотон и переходя на более низкий уровень энергии (наряду с таким спонтанным испусканием возможно и вынужденное испускание, происходящее, подобно поглощению, под действием фотонов той же частоты; см. Квантовые переходы). Время жизни возбуждённого атома тем меньше, чем больше вероятность спонтанного перехода. Для возбуждённых атомов водорода это время порядка 10—8 сек.
Совокупность частот возможных переходов с излучением определяет оптический спектр соответствующего атома: совокупность частот переходов с нижних уровней на верхние — его спектр поглощения, совокупность частот переходов с верхних уровней на нижние — его спектр испускания. Каждому такому переходу соответствует определённая спектральная линия. Для атома водорода, согласно формулам (4) и (8), получаем совокупность спектральных линий с частотами
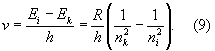
При nk = 1 и nI = 2, 3, 4, 5, ... получается спектральная серия Лаймана (линии La, Lb., Lg,...), при nk = 2 и ni= 3, 4,5,... — серия Бальмера (линии Нa, Hb, Нg ...), при nk = 3 и nI = 4, 5, ... — серия Пашена (рис. 1, б). Для атомов других элементов в соответствии с более сложной схемой уровней энергии получается и более сложный спектр (см. Атомные спектры).
Квантовые переходы без излучения. При этих переходах атом получает или отдаёт энергию при взаимодействии с другими частицами, с которыми он сталкивается в газе или длительно связан в молекуле, жидкости или твёрдом теле. В газе атом можно считать свободным в промежутках времени между столкновениями; во время столкновения (удара) атом может, благодаря кратковременному взаимодействию, перейти на другой уровень энергии. Такое столкновение называется неупругим (в противоположность упругому столкновению, при котором изменяется только кинетическая энергия поступательного движения атома, а его внутренняя энергия остаётся неизменной). Важный частный случай — столкновение свободного атома с электроном; обычно электрон движется быстро по сравнению с атомом, время столкновения очень мало и можно говорить об электронном ударе. Возбуждение атома электронным ударом является одним из методов определения уровней энергии атома. Вероятности неупругих столкновений и, в частности, возбуждения атома электронным ударом могут быть рассчитаны методами квантовой механики (см. Столкновения атомные).
Химические и физические свойства атома. Большинство свойств атома определяется строением и характеристиками его внешних электронных оболочек, в которых электроны связаны сравнительно слабо (энергии связи от нескольких эв до нескольких десятков эв). Строение внутренних оболочек атома, электроны которых связаны гораздо прочнее (энергии связи в сотни, тысячи и десятки тысяч эв), проявляется лишь при взаимодействиях атома с быстрыми частицами и фотонами больших энергий (более сотен эв.) Такие взаимодействия определяют рентгеновские спектры атома и рассеяние атомом быстрых частиц (см. Рассеяние микрочастиц, Дифракция частиц). От массы атома, определяемой массой его ядра, зависят его механические свойства при движении атома как целого — количество движения, кинетическая энергия. От механических и связанных с ними магнитных и электрических моментов атома зависят некоторые тонкие эффекты, проявляющиеся при изучении физических свойств атома (см. Моменты атомных ядер, Ядерный магнитный резонанс, Ядерный квадрупольный резонанс, Сверхтонкая структура).
Свойства атома, определяемые его внешними электронами. Электроны во внешних оболочках атома, связанные сравнительно слабо, легко подвергаются внешним воздействиям. При сближении данного атома с другими возникают сильные электростатические взаимодействия (включая т. н. обменные взаимодействия), которые могут приводить к возникновению химической связи атомов, т. е. к образованию молекулы. В химической связи участвуют электроны внешних оболочек; в случае ковалентной связи эти электроны принадлежат уже не отдельным атомам, а образовавшейся молекуле в целом, и входят в состав её молекулярных электронных оболочек. Т. о., внешние электроны атома определяют его химические свойства.
Более слабые электростатические взаимодействия двух атомов проявляются в их взаимной поляризации — смещении электронов относительно ядер, наиболее сильном для слабо связанных внешних электронов (см. Поляризация частиц). Возникают поляризационные силы притяжения между атомами, которые надо учитывать уже на больших расстояниях между ними (см. Межмолекулярное взаимодействие). Поляризация атома происходит и во внешних электрических полях; в результате уровни энергии атома смещаются и, что особенно важно, вырожденные уровни энергии расщепляются (поляризация различна для различных квантовых состояний атома, соответствующих той же его энергии) — имеет место Штарка явление. Поляризация атома может возникнуть под действием электрического поля световой (электромагнитной) волны; она зависит от частоты света, что обусловливает зависимость от неё и показателя преломления (см. Дисперсия света), связанного со способностью атома поляризоваться — с поляризуемостью атома (см. Поляризуемость атомов, ионов и молекул). Тесная связь оптических характеристик атома с его электрическими свойствами особенно ярко проявляется в его оптических спектрах.
Внешними электронами определяются и магнитные свойства атома. Они схожи для элементов с аналогичными внешними электронными оболочками атома. Магнитный момент атома зависит от его механического момента (см. Магнитомеханическое отношение), в атоме с полностью заполненными электронными оболочками он равен нулю, так же как и механический момент. При наличии частично заполненных внешних электронных оболочек магнитные моменты атомов, как правило, постоянны, и атомы являются парамагнитными (см. Парамагнетизм). Во внешнем магнитном поле все уровни атомов, у которых магнитный момент не равен нулю, расщепляются (см. Зеемана явление). Все атомы обладают диамагнетизмом, который обусловлен возникновением у них магнитного момента под действием магнитного поля (т. н. индуцированного магнитного момента, аналогичного электрическому дипольному моменту атома).
Свойства ионизованного атома. При последовательной ионизации атома, т. е. при отрыве его электронов, начиная с самых внешних, в порядке увеличения прочности их связи (рис. 5), соответственно изменяются все свойства атома, определяемые его внешней оболочкой. Внешними становятся все более прочно связанные электроны; в результате сильно уменьшается способность атома поляризоваться в электрическое поле, увеличиваются расстояния между уровнями энергии и частоты оптических переходов между этими уровнями (что приводит к смещению спектров в сторону всё более коротких длин волн). Ряд свойств обнаруживает периодичность: сходными оказываются свойства ионов с аналогичными внешними электронами, например N7+ и N3+ (один и два электрона 2s) обнаруживают сходство с N6+ и N5+ (один и два электрона 1s). Это относится к характеристикам и относительному расположению уровней энергии и к оптическим спектрам, к магнитным моментам атома и т. д. Наиболее резкое изменение свойств происходит при удалении последнего электрона из внешней оболочки, когда остаются лишь полностью заполненные оболочки; например при переходе от N4+ к N5+ (электронные конфигурации 1s22s и 1s2). В этом случае ион наиболее устойчив и его полный механический и полный магнитный моменты равны нулю. Особенно устойчивы, помимо ионов с электронной конфигурацией 1s2, ионы с полностью заполненной внешней оболочкой nр(n = 2, 3, 4, ...).
Свойства связанных атомов. Свойства атома, находящегося в связанном состоянии, например входящего в состав молекулы, отличаются от свойств свободного атома. Наибольшие изменения претерпевают свойства атома, определяемые самыми внешними электронами, принимающими участие в присоединении данного атома к другому. Вместе с тем свойства, определяемые электронами внутренних оболочек, могут практически не измениться, как это имеет место для рентгеновских спектров. Некоторые свойства атома могут испытывать сравнительно небольшие изменения, по которым можно получить информацию о характере взаимодействий связанных атомов. Важным примером может служить расщепление уровней энергии атомов в кристаллах и комплексных соединениях, которое происходит под действием электрических полей, создаваемых окружающими ионами (см. Кристаллического поля теория).
Лит. см. при ст. Атомная физика.
М. А. Ельяшевич.
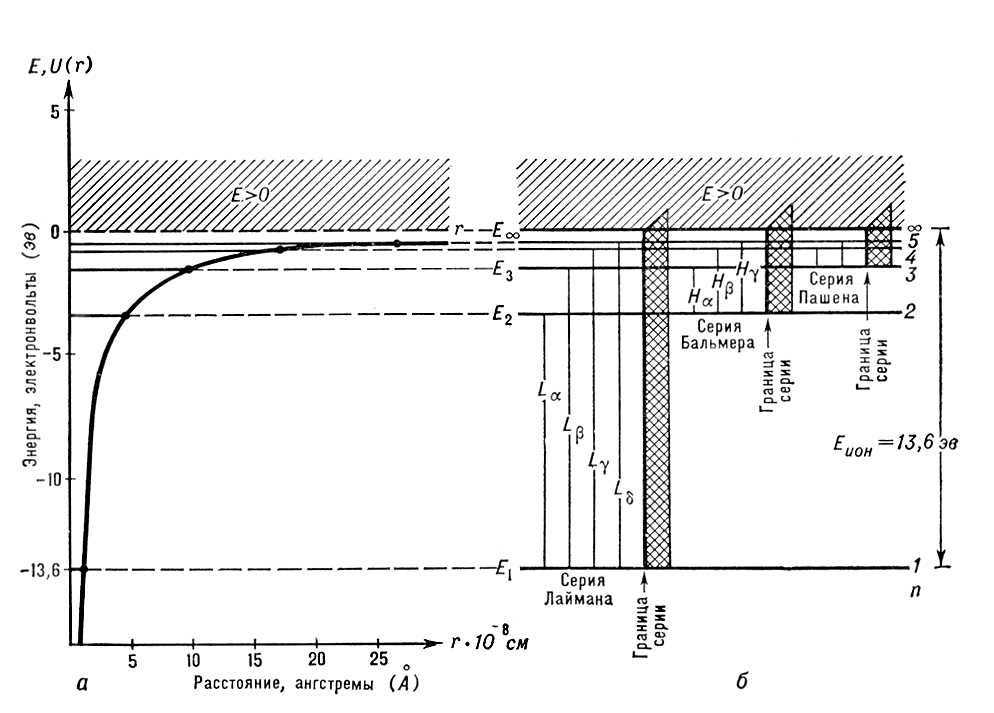
Рис. 1. Энергия атома водорода: а — возможные значения полной энергии E1, E2, E3, ... (горизонтальные линии) и график потенциальной энергии (жирная кривая; точками показаны значения rmax при Е = E1, E2, E3 ,...); б — схема уровней энергии (горизонтальные линии) и оптических квантовых переходов (вертикальные линии). Заштрихованная область (Е > 0) соответствует свободному состоянию электрона.
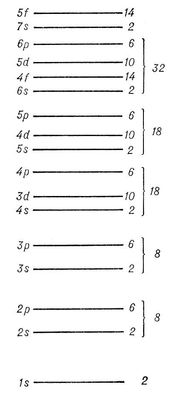
Рис. 4. Последовательность заполнения уровней энергии отдельного электрона в сложном атоме. Справа даны числа заполнения оболочек.

Рис. 2. Возможные состояния атома водорода при значениях n = 1, 2, 3. Графически показаны ориентации орбитального и спинового моментов.
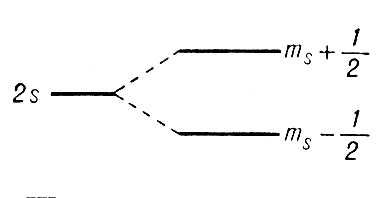
Рис. 3. Расщепление уровня энергии во внешнем магнитном поле.