Полигалоидные производные этилена
Многие полигалоидные производные этилена могут быть получены, исходя из ацетилена. Присоединением хлора к ацетилену легко получается так называемый четыреххлористый ацетилен, или симметрический тетрахлорэтан:

При действии на тетрахлорэтан влажной цинковой пыли получается симметрический дихлорэтилен:
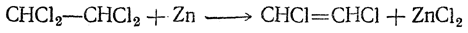
Это — жидкость, кипящая при 55° С. Она может быть разделена фракционированием на два геометрических изомера: цис-изомер, кипящий при 60° С, и транс-изомер, кипящий при 48° С.
Хлористый винилиден, или несимметрический дихлорэтилен, СН2=ССl2 — жидкость, кипящая при 30,7° С, относительная плотность d420 — 1,213. Получается отщеплением хлористого водорода при помощи щелочей от 1,2,2-трихлорэтана:

Хлористый винилиден полимеризуется под действием света или перекисных соединений. Совместной полимеризацией с хлористым винилом получается эластичный, водонепроницаемый изолирующий материал (саран).
Трихлорэтилен получается из тетрахлорэтана кипячением его с известью или пиролизом:
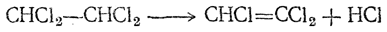
Он представляет собой жидкость, кипящую при 87,2° С; относительная плотность 1,440 (при 15° С). Трихлорэтилен является превосходным растворителем для жиров, а также для серы. Вследствие этого, а также ввиду малой горючести он приобрел большое техническое значение как растворитель для экстракции масел и для других целей.
Тетрахлорэтилен, или перхлорэтилен, ССl2=ССl2 — жидкость с т. кип. 121° С, относительная плотность 1,624 (при 15° С). Получается при нагревании без доступа воздуха различных полихлорпроизводных углеводородов, например четыреххлористого углерода. Легче всего его можно получить, нагревая гексахлорэтан в присутствии хлористого алюминия:
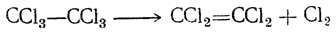
Вследствие малой токсичности перхлорэтилен приобретает большое значение как растворитель (например, для «сухой» чистки одежды).
Сухой кислород на солнечном свету, а также серный ангидрид при нагревании легко окисляют тетрахлорзтилен, причем образуется аномальный продукт окисления (с перегруппировкой атомов хлора) ССl3—СОСl, т. е. хлорангидрид трихлоруксусной кислоты
Весьма интересное соединение представляет собой тетрафторэтилен, получаемый пиролизом дифторхлорметана:

Тетрафторэтилен — бесцветный газ, сгущающийся под атмосферным давлением в жидкость при —76° С. Он способен полимеризоваться при нагревании до +60° С (под давлением) с разбавленным водным раствором перекиси водорода. Его полимер в обычных условиях напоминает жесткую резину, около 320° С становится прозрачным и приобретает при этом пластичность. Термическое разложение начинается лишь около 450° С. На этот полимер, называемый тефлоном, не действуют концентрированные кислоты (даже кипящая азотная кислота и нагретая до 300° С концентрированная серная кислота) и расплавленный NaOH. Металлический натрий лишь при 200° С медленно отщепляет фтор. Так как вещество не набухает и не растворяется в органических растворителях, то нет возможности обычными методами оценить его молекулярный вес и степень полимеризации.
Моногалоидные производные ацетилена могут быть получены из дигалоидных производных этилена отнятием одной молекулы галоидоводорода:
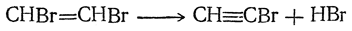
Монохлорацетилен СН≡ССl и монобромацетилен СН≡СВr представляют собой легко разлагающиеся газы. На воздухе монобромацетилен самовоспламеняется. Моноиодацетилен — жидкость с т кип. 32° С.
Люизит. Взаимодействием ацетилена с хлористым мышьяком в присутствии хлористого алюминия получается люизит, применявшийся в первую мировую войну в качестве отравляющего вещества кожно-нарывного действия. Люизит представляет собой жидкую смесь трех продуктов:
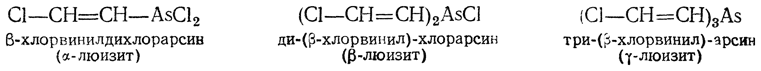
α-Люизит (желтоватая жидкость, т. кип. 93° С при 26 мм рт. ст.) по токсичности значительно превосходит β- и γ- люизит. Он образуется по уравнению
НС≡СН + AsCl3 → Cl—CH=CH—AsCl2
Люизит гораздо менее стоек в отношении гидролиза и окисления, чем иприт Концентрированные щелочи быстро разрушают его с выделением ацетилена.
Интересным свойством обладает 2,3-димеркаптопропанол, так называемый «английский антилюизит» CH2(SH)—CH(SH)—СН2ОН. Обработка им пораженных люизитом участков кожи предохраняет от нарывного действия. 2,3-Димеркаптопропанол — жидкость с относительной плотностью около 1,25 (при 20° С) и т. кип. 89° С (при 0,5 мм рт. ст.).


