Фотокатализ
ФОТОКАТАЛИЗ, ускорение хим. р-ции, обусловленное совместным действием катализатора и облучения светом. Для кинетики фотокаталитич. р-ций характерны те же закономерности, что и для каталитич. и фотохим. р-ций (см. Каталитических реакций кинетика, Фотохимические реакции). Особенность фотокаталитич. р-ций состоит в том, что раздельное действие света или катализатора не оказывает значит. влияния на скорость р-ции. Фотокатализ широко распространен в природе (см., напр., Фотосинтез).
Типы фотокаталитич. р-ций: 1) Фотоиндуциро-ванный катализ: 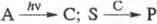 . При поглощении фотона с энергией hv (h - постоянная Планка, v -частота излучения) неактивное в-во А (прекьюсор) превращается в катализатор С; превращение субстрата S в продукт P, катализируемое С, является термич. (темновым) процессом. Квантовый выход
. При поглощении фотона с энергией hv (h - постоянная Планка, v -частота излучения) неактивное в-во А (прекьюсор) превращается в катализатор С; превращение субстрата S в продукт P, катализируемое С, является термич. (темновым) процессом. Квантовый выход 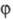 м. б. > 1, т. к. р-ция может идти и после прекращения облучения.
м. б. > 1, т. к. р-ция может идти и после прекращения облучения.
2) Фотоактивированный катализ: 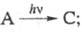
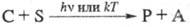 (kT - энергия теплового движения частиц, T - абс. т-ра, k - постоянная Больцмана). Это наиб. распространенный процесс. В отличие от предыдущего случая, катализатор С вызывает превращение субстрата S в продукт P фотохим. или термич. путем, превращаясь при этом в прекьюсор А. Таким образом, А регенерируется в этом процессе, однако для осуществления след, цикла необходимо поглощение дополнит. фотона. Для фотоактивированных р-ций
(kT - энергия теплового движения частиц, T - абс. т-ра, k - постоянная Больцмана). Это наиб. распространенный процесс. В отличие от предыдущего случая, катализатор С вызывает превращение субстрата S в продукт P фотохим. или термич. путем, превращаясь при этом в прекьюсор А. Таким образом, А регенерируется в этом процессе, однако для осуществления след, цикла необходимо поглощение дополнит. фотона. Для фотоактивированных р-ций 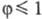 , эти р-ции не идут в отсутствие облучения.
, эти р-ции не идут в отсутствие облучения.
3) Каталитич. фотореакции: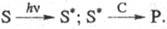
Катализатор реагирует с возбужденным состоянием субстрата S*, к-рое затем превращается в продукт P. В отличие от процессов 1 и 2 фотон hv поглощается непосредственно субстратом, фотоактивации катализатора не требуется.
Фотокаталитич. системы. В гомогенных системах в качестве катализаторов чаще всего используют комплексы переходных металлов с неорг. и орг. лигандами. В металлокомп-лексном фотокатализе образующийся в результате поглощения фотона катализатор может представлять собой координационно ненасыщенный комплекс металла, ион металла или комплекс в промежут. окислит.-восстановит. состоянии либо реакцион-носпособные частицы (напр., своб. радикалы), возникающие из лигандов при фотохим. р-ции. В гетерогенных системах (твердое тело - газ или твердое тело - жидкость) в качестве фотокатализаторов используют полупроводниковые оксиды или сульфиды (TiO2, ZnO, CdS и др.), полупроводниковые оксиды с нанесенными металлами (напр., Pt/TiO2, Rh/SrTiO3) и полупроводниковые дисперсии с нанесенными оксидами (напр., RuO2/TiO2). Активными центрами р-ции являются дырки и электроны, образующиеся в полупроводнике при облучении светом.
Наиб. распространены след. процессы фотокатализа.
1) Фотоокисление и фотовосстановление неорг. и орг. субстратов; фотокатализаторы - р-ры солей и комплексов переходных металлов, ZnO, TiO2, WO3, SnO2 и др.; субстраты - СО, H2, NH3, H2O, CN-, спирты, алканы, алкены и др.
2) Фотогидрирование и фотодегидрирование (напр., фотоприсоединение H2 к диенам на карбонильных комплексах Cr, фотодегидрирование ацетона и спиртов на порошках TiO2 и ZnO).
3) Фотодимеризация и фотополимеризация (напр., фото-димеризация олефинов в присут. комплексов Cu, Со, Cr, Ni, Rh).
4) Фотоизомеризация и диспропорционирование (напр., циc-транс-фотоизомеризация олефинов и перемещение двойной связи в олефинах в присут. карбонилов W, Mo, Cr, Fe, Ni).
5) Фотоадсорбция кислорода на полупроводниковых оксидах (ZnO, TiO2 и др.), фотодесорбция CO2 с пов-сти ZnO.
6) Фотообмен кислорода и водорода (TiO2, ZnO, ZrO2, SnO2, V2O5 и др.).
7) Фотоосаждение металлов (Pt, Cu, Pd, Ag и др.) из их солей на пов-сть полупроводниковых дисперсий. Процессы (5) - (7) известны только для гетерогенных систем.
Применение. Использование фотокатализа представляет большой интерес в связи с проблемой утилизации солнечной энергии. С помощью таких р-ций, происходящих с запасанием своб. энергии  системы, в принципе можно получить высоко-энергетич. и экологически чистое топливо из воды и газов атмосферы, являющихся доступным и практически неисчерпаемым сырьем. Одна из самых перспективных р-ций - фо-токаталитич. разложение воды на H2 и O2 при облучении видимым или УФ светом. Этот процесс м. б. осуществлен в микрогетерогенных системах; обычно его изображают след. схемой (ФК - фотокатализатор):
системы, в принципе можно получить высоко-энергетич. и экологически чистое топливо из воды и газов атмосферы, являющихся доступным и практически неисчерпаемым сырьем. Одна из самых перспективных р-ций - фо-токаталитич. разложение воды на H2 и O2 при облучении видимым или УФ светом. Этот процесс м. б. осуществлен в микрогетерогенных системах; обычно его изображают след. схемой (ФК - фотокатализатор):
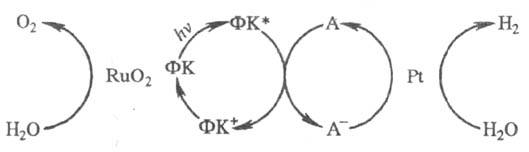
В фотохим. стадии из (фотокатализатора при участии возбужденного состояния ФК* по сопряженной р-ции с акцептором А образуются достаточно сильный окислитель ФК+ и восстановитель А-, т. е. происходит разделение зарядов. В качестве ФК часто используют комплекс 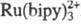 , где biру - 2,2'-бипиридин, а в качестве А - орг. бикатион N,N'-диметил-4,4'-бипиридина (метилвиологен, MB2+). При применении в качестве ФК полупроводниковых систем роль ФК+ и А- играют соотв. дырки в валентной зоне и электроны в зоне проводимости. Выделение H2 и O2 осуществляется в темновых каталитич. р-циях при взаимод. соотв. А- и ФК+ с H2O. В качестве катализаторов этих процессов обычно используют коллоидные Pt и RuO2.
, где biру - 2,2'-бипиридин, а в качестве А - орг. бикатион N,N'-диметил-4,4'-бипиридина (метилвиологен, MB2+). При применении в качестве ФК полупроводниковых систем роль ФК+ и А- играют соотв. дырки в валентной зоне и электроны в зоне проводимости. Выделение H2 и O2 осуществляется в темновых каталитич. р-циях при взаимод. соотв. А- и ФК+ с H2O. В качестве катализаторов этих процессов обычно используют коллоидные Pt и RuO2.
Запасание хим. энергии м. б. осуществлено и в результате проведения такой фотокаталитич. р-ции, к-рая позволяет получить более энергоемкое в-во (напр., в результате фотоизомеризации норборнадиена в квадрициклен в присут. Cu(I), 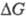 = 1 кДж/г). В полиграфии (рельефная печать, гравюра, литография и др.) используют фотоиндуцированную полимеризацию дихроматных золей желатина или альбумина (или поливинилового спирта).
= 1 кДж/г). В полиграфии (рельефная печать, гравюра, литография и др.) используют фотоиндуцированную полимеризацию дихроматных золей желатина или альбумина (или поливинилового спирта).
Лит.: Энергетические ресурсы сквозь призму фотохимии и катализа, пер. с англ., M., 1986; Ляшенко Л.В., в сб.: Катализ и катализаторы, в. 23, К., 1985, с. 3-17; Hennig H. [а. о.], "Coord. Chem. Rev.", 1985, v. 61, p. 1-53.
Б.Н. Шалимов.
