Химические свойства предельных углеводородов (алканов)
Углеводороды ряда метана при обыкновенной температуре химически весьма инертны, почему они и получили название парафинов (от латинских слов parum affinis — обладающий малым сродством). С большинством химических реагентов эти углеводороды в указанных условиях или вовсе не реагируют, или реагируют чрезвычайно медленно. При сравнительно невысоких температурах протекает лишь небольшое число реакций, при которых происходит замена атомов водорода на различные атомы и группы (реакции металеп-cuu). Эти реакции ведут к получению производных соответствующих углеводородов.
К реакциям присоединения парафины вообще неспособны в силу насыщенности всех связей атомов углерода.
1. Действие галогенов
Важной реакцией парафиновых углеводородов является взаимодействие их с галоидами На свету эти углеводороды могут последовательно замещать атомы водорода на атомы галоида, например:
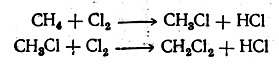
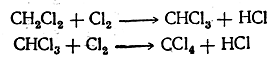
При этих реакциях хлор действует энергичнее других галоидов. Труднее всего реагирует иод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и иода (обратимая реакция):

Чтобы реакция дошла до конца, необходимо образующийся йодистый водород все время удалять из сферы реакции (па-пример, добавлением окиси ртути или йодноватой кислоты).
2. Действие азотной кислоты
Азотная кислота при обыкновенной температуре почти не действует на парафиновые углеводороды; при нагревании же действует главным образом как окислитель. Однако, как нашел М. И. Коновалов (1889), при нагревании азотная кислота действует отчасти и «нитрующим» образом; особенно хорошо идет реакция нитрования со слабой азотной кислотой при нагревании и повышенном давлении. Реакция нитрования выражается уравнением

т. е. один из атомов водорода заменяется на остаток NO2 (ни-трогруппа) и выделяется вода.
Особенности строения изомеров сильно отражаются на течении этой реакции, так как легче всего она ведет к замещению на нитрогруппу атома водорода в остатке СИ (имеющемся лишь в некоторых изомерах), менее легко замещается водород в группе СН2 и еще труднее — в остатке СН3.
Парафины довольно легко нитруются в газовой фазе при 150—475° С двуокисью азота или парами азотной кислоты; при этом происходит частично и. окисление. Нитрованием метана получается почти исключительно нитрометан:
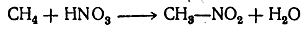
Последующие гомологи дают смесь различных нитропарафинов вследствие попутно идущего расщепления. При нитровании этана получаются нитроэтан СН3—СН2—NO2 и нитрометан СН3—NO2. Из пропана образуется смесь нитропарафинов:
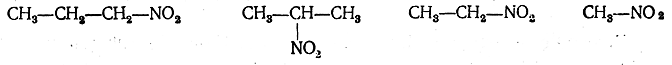
Из нормального бутана:
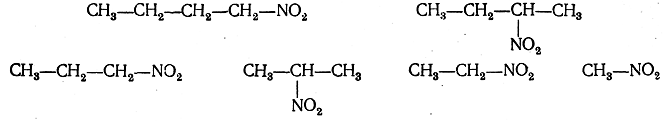
Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе.
3. Действие серной кислоты
Серная кислота при обыкновенной температуре не действует на парафины; при высокой температуре действует как окислитель. При слабом нагревании дымящая серная кислота может действовать на парафиновые углеводороды (особенно на углеводороды изострое-ния, содержащие группу СН), образуя сульфокислоту и воду (реакция сульфирования):
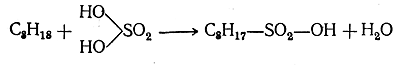
4. Одновременное действие сернистого ангидрида и кислорода
При совместном действии сернистого ангидрида и кислорода воздуха под влиянием ультрафиолетовых лучей или добавок перекисей парафиновые углеводороды, даже нормального строения, реагируют с образованием суль-фокислот (реакция сульфоокисления):
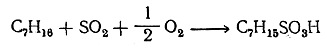
5. Одновременное действие сернистого ангидрида и хлора
При совместном действии сернистого ангидрида и хлора при освещении ультрафиолетовым излучением или под влиянием некоторых катализаторов происходит замещение атома водорода с образованием так называемых сульфохлори-дов (реакция сульфохлорирования):
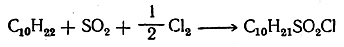
Вместо смеси SO2 и Cl2 можно пользоваться хлористым сульфурилом.
6. Действие кислорода и окислителей
Кислород и окислители, даже такие сильные, как хромовая кислота и пер-манганат, при обыкновенной температуре почти не действуют на парафиновые углеводороды. При повышенной температуре сильные окислители медленно действуют на предельные углево-
дороды таким образом, что в каком-нибудь месте молекулы разрывается связь между атомами углерода и молекула распадается на отдельные осколки, окисляющиеся при этом в органические кислоты. Эти кислоты всегда содержат в молекуле меньшее число атомов углерода, чем исходный углеводород, т. е. реакции окисления являются всегда реакциями распада (расщепления) молекулы углеводорода.
Газообразный кислород при обыкновенной температуре воз-се или почти не действует на парафины. При высокой температуре углеводороды воспламеняются и горят, причем происходит полное разрушение органической молекулы, ведущее к образованию углекислого газа и воды. Лишь сравнительно недавно было исследовано действие кислорода и воздуха на алканы (преимущественно твердые) при средних температурах, когда окисление протекает довольно энергично, но не приводит к воспламенению. Оказалось, что и в этом случае происходит частичное расщепление молекул углеводородов с образованием кислородсодержащих веществ, главным образом органических кислот. В настоящее время окисление смеси высших твердых предельных углеводородов — окисление парафина - проводится в крупных промышленных масштабах для получения жирных кислот.
В последнее время промышленное значение получает так называемое регулируемое (проводимое при сравнительно низких температурах) окисление кислородом или воздухом также и низших предельных углеводородов: метана, этана, пропана и бутана. При этом получаются смеси спиртов, альдегидов, ке-тонов и кислот, причем промежуточно образуются, очевидно, простейшие перекисные соединения. При окислении пропана, например, могут получаться следующие вещества:
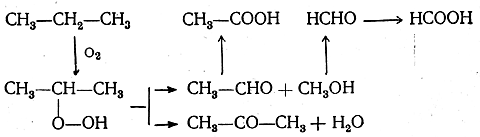
Обычно окисление пропана в промышленных условиях проводят таким образом, чтобы получить возможно больше ацетальдегида.
7. Действие высоких температур
При высоких температурах все парафиновые углеводороды подвергаются более или менее глубокому распаду с разрывом связей С—С или С—Н. При этом образуются продукты, состав которых зависит от условий термического воздействия (температура, давление, продолжительность нагревания) и от природы углеводорода. Так как осуществление этич процессов в принципе несложно, а получающиеся продукты являются ценным топливом и важным сырьем для химической промышленности, этот путь использования парафиновых углеводородов интенсивно изучался и широко распространен.
Метан лучше всех других углеводородов выдерживает нагревание: он начинает заметно разлагаться лишь около 800° С. Важнейшим продуктом превращения метана является ацетилен, который получается с хорошим выходом только в специальных условиях. Одновременно получаются этилен к водород. При понижении температуры содержание ацетилена в продуктах распада понижается, а этилена — увеличивается; понижение давления способствует увеличению выхода обоих углеводородов. Выше 1600° С, а также при длительном нагревании до 800—1600° С метан распадается главным образом на углерод и водород.
Этан при температуре 575—1000е С распадается преимущественно на этилен, ацетилен и водород; при дальнейшем нагревании происходит обугливание и вместе с тем образование ароматических углеводородов.
Термический распад более сложных углеводородов происходит по-разному в зависимости от температуры. Чем длиннее и разветвленнее углеродный скелет молекулы парафина, тем легче происходит термическое разложение. Так, одинаковая степень термического распада достигается у пропана при 700— 800° С, а у бутана при 650—750° С. Следующие гомологи начинают распадаться при еще более низких температурах.
Химические реакции, происходящие при термическом распаде углеводородов, обычно называют крекингом (англ. — растрескивание, разламывание). Механизм процесса крекинга довольно сложен. Первичными продуктами реакции являются свободные радикалы, вступающие затем во взаимодействие между собой и с другими молекулами. Конечными продуктами крекинга, проводимого при 450—550 °С, являются смеси более низкомолекулярных углеводородов (насыщенных, ненасыщенных и циклических). При 550—650°С происходит более глубокий крекинг: получается много углистого остатка (кокса), простейших газообразных углеводородов (насыщенных и ненасыщенных), а также смесь жидких углеводородов, в которой преобладают ароматические углеводороды. При более длительном нагревании образуется больше циклических углеводородов и меньше ненасыщенных. Выше 1000° С распад идет уже главным образом до углерода (кокс) и водорода. Крекинг высших углеводородов в атмосфере водорода, особенно под давлением и в присутствии катализаторов (например, окиси железа), приводит к смеси, в которой преобладают парафиновые углеводороды (Бергиус).


