Хлоруксусная кислота (альфа-форма)
Внешний вид:
бесцветн. моноклинные кристаллы Кристаллические модификации, цвет растворов и паров:
Существует в 4 модификациях - альфа (моноклинная, параметры решетки: a=0,538 нм, b=1,927 нм, c=0,801 нм, β=109,5°, z=8, пространственная группа P21/c), бета, гамма, дельта.Брутто-формула (система Хилла): C2H3ClO2
Формула в виде текста: ClCH2COOH
Молекулярная масса (в а.е.м.): 94,49
Температура плавления (в °C): 62,5
Температура кипения (в °C): 187,85
Растворимость (в г/100 г или характеристика):
бензол: растворимвода: хорошо растворим
диэтиловый эфир: растворим
сероуглерод: растворим
хлороформ: растворим
этанол: растворим
Вкус, запах, гигроскопичность:
гигроскопиченМетод получения 1.
(лабораторный синтез)Источник информации: "Препаративная органическая химия" М. 1959 стр. 181-182
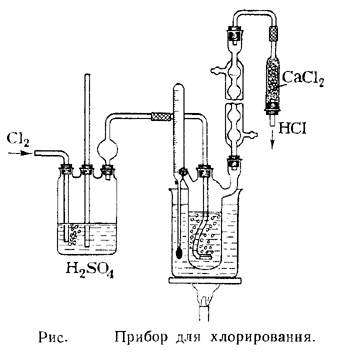 Прибор для хлорирования изображен на рисунке. В трехгорлую колбу емкостью 500 мл помещают смесь 300 г (5 молей) ледяной уксусной кислоты и 15 г (0,14 моля) уксусного ангидрида и нагревают на масляной бане. По достижении температуры 105° начинают постепенно вводить хлор, поддерживая температуру масляной бани в течение всего периода хлорирования в пределах 108— 112°. Через несколько минут после начала введения хлора начинается реакция; желтая (от растворенного хлора) окраска уксусной кислоты исчезает и выделяется хлористый водород. С этого момента следует значительно увеличить скорость пропускания хлора, регулируя, однако, ее таким образом, чтобы из колбы не выходили желтые пары хлора. Хлорирование продолжают около 10 часов (примечание 4). Каждые 2 часа к хлорируемой смеси добавляют по 5 г уксусного ангидрида. Конец хлорирования определяют по значительному уменьшению количества выделяющегося хлористого водорода или путем определения температуры плавления отбираемой пробы. Хлорирование прекращают, когда проба сырой хлоруксусной кислоты будет плавиться при температуре 45—50°. Расплавленный продукт реакции переносят в перегонную колбу и после отгонки небольшого количества предгона собирают фракцию хлоруксусной кислоты, кипящую при температуре 186—188°; при застывании образуются кристаллы с резким запахом. Выход (примечание 5) — 425 г (90% от теоретического).
Прибор для хлорирования изображен на рисунке. В трехгорлую колбу емкостью 500 мл помещают смесь 300 г (5 молей) ледяной уксусной кислоты и 15 г (0,14 моля) уксусного ангидрида и нагревают на масляной бане. По достижении температуры 105° начинают постепенно вводить хлор, поддерживая температуру масляной бани в течение всего периода хлорирования в пределах 108— 112°. Через несколько минут после начала введения хлора начинается реакция; желтая (от растворенного хлора) окраска уксусной кислоты исчезает и выделяется хлористый водород. С этого момента следует значительно увеличить скорость пропускания хлора, регулируя, однако, ее таким образом, чтобы из колбы не выходили желтые пары хлора. Хлорирование продолжают около 10 часов (примечание 4). Каждые 2 часа к хлорируемой смеси добавляют по 5 г уксусного ангидрида. Конец хлорирования определяют по значительному уменьшению количества выделяющегося хлористого водорода или путем определения температуры плавления отбираемой пробы. Хлорирование прекращают, когда проба сырой хлоруксусной кислоты будет плавиться при температуре 45—50°. Расплавленный продукт реакции переносят в перегонную колбу и после отгонки небольшого количества предгона собирают фракцию хлоруксусной кислоты, кипящую при температуре 186—188°; при застывании образуются кристаллы с резким запахом. Выход (примечание 5) — 425 г (90% от теоретического).
Примечания
1. По мере возможности хлорирование следует проводить в приборе на шлифах; можно также применять хорошие корковые пробки; не рекомендуется применять резиновые пробки.
2. Для распыления газа в жидкости применяют барботеры с пористыми пластинками (пластинка № 2). Для проведения хлорирования очень удобна модифицированная (путем припаивания вводной трубки к трубке тубуса для обратного холодильника) склянка Келикера с пористым дном.
3. В качестве масляной бани применяют довольно высокий сосуд емкостью 1 л, наполненный вазелиновым маслом.
4. Хлорирование можно прерывать, оставляя раствор на ночь.
5. Описанный способ успешно применяют для получения хлоруксусной кислоты в больших количествах.
Способы получения:
1. Хлорирование уксусной кислоты в присутствии катализаторов (фосфор, сера, уксусный ангидрид) при 100-150 С.2. Кислотная гидратация 1,1,2-трихлорэтилена 90-93% серной кислотой при 160-180 С.
3. Хлорирование кетена.
4. Восстановление ди- или трихлоруксусной кислоты.
5. Реакцией уксусной кислоты с тионилхлоридом при 115-120 С и 0,4-0,5 МПа.
Плотность:
1,58 (20°C, г/см3)1,4043 (40°C, г/см3)
1,3703 (65°C, г/см3)
Показатель преломления (для D-линии натрия):
1,4351 (55°C)Давление паров (в мм.рт.ст.):
20 (104°C)100 (132°C)
300 (160°C)
Показатель диссоциации:
pKa (1) = 2,86 (25 C, вода)Диэлектрическая проницаемость:
12,3 (60°C)Динамическая вязкость жидкостей и газов (в мПа·с):
1,29 (100°C)Поверхностное натяжение (в мН/м):
35,17 (100°C)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-504,6 (т)Энтальпия плавления ΔHпл (кДж/моль):
12,28Температура вспышки в воздухе (°C):
132Температура самовоспламенения на воздухе (°C):
446Теплота сгорания Qp (кДж/моль):
715,5Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-490,1 (ж)Летальная доза (ЛД50, в мг/кг):
76 (крысы, перорально)ПДК (мг/л):
в воздухе рабочей зоны = 0,001Применение:
В синтезе красителей, лекарственных средств, гербицидов, витаминов.
Дополнительная информация:
Легко вступает в реакции нуклеофильного замещения Cl. При обработке горячим спиртовым раствором этилата натрия образует этоксиуксусную кислоту, с щелочным раствором фенола - феноксиуксусную кислоту, с цианидами щелочных металлов - циануксусная кислота, с этилендиамином - этилендиаминтетрауксусная кислота, с щелочами - глиокиловая кислота, с водным раствором гидросульфида калия - тиогликолевая кислота. Реакция с анилином - промышленный способ получения индиго, реакцией с аммиаком получают глицин, с метиламином - саркозин, с щелочной целлюлозой - карбоксиметилцеллюлозу.
- "Химическая энциклопедия" т.5 М.: Советская энциклопедия, 1999 стр. 296-297
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 191-192, 223
