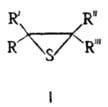
Олефинов тиооксиды
ОЛЕФИНОВ ТИООКСИДЫ (тиираны, алкиленсульфиды, a-тиооксиды), соед. общей ф-лы I, где R-R''' = Н, Alk, Ar. Называют олефинов тиооксиды как производные простейшего олефинов тиооксида -тиирана (этиленсульфида, в ф-ле I R-R''' = H) или по назв. соответствующего олефина, напр. метилтииран, или пропилен-сульфид.
Соед., содержащие олефинов тиооксиды, встречаются в природе, напр. входят в состав эфирного масла хмеля.
Олефинов тиооксиды-бесцв. (или светло-желтые) жидкости с неприятным запахом или низкоплавкие кристаллы; хорошо раств. во мн. орг. р-рителях (ограниченно - в низших спиртах), не раств. в воде. При нагр. выше 100-200 СС разлагаются.
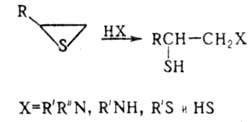
Под действием нуклеоф. агентов олефинов тиооксиды обычно региоспе-цифично или региоселективно раскрывают цикл по связи С—S у наиб. гидрогенизир. атома углерода (по правилу Красуского), напр.:
Р-ции с алкоголятами и аллил- или бензилгалогенидами приводят к  -алкоксисульфидам:
-алкоксисульфидам:
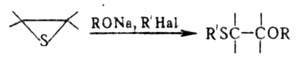
Взаимод. с нек-рыми СН-кислотами в присут. оснований протекает с расширением цикла, напр.:
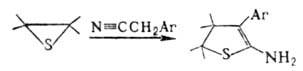
Аналогично происходит р-ция с CS2, COS, ксантогенатами, изотиоцианатами, напр.:
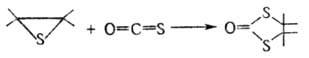
К этому типу р-ций относится тииран-тиетановая перегруппировка -галогеналкилзамещенных олефинов тиооксидов при р-циях с О- и S-нуклеофилами:
-галогеналкилзамещенных олефинов тиооксидов при р-циях с О- и S-нуклеофилами:
. 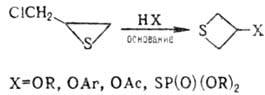
Региоселективность раскрытия цикла олефинов тиооксидов электрофилами ниже, чем нуклеофилами. При взаимод. с НСl и НВг в безводных средах и конц. водных р-рах олефинов тиооксиды превращаются в
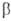 -галогеналкантиолы. Р-ции с HI приводят к бис-(2-гало-геналкил)дисульфидам. С HHal в р-рах ангидридов к-т олефинов тиооксиды превращаются в S-
-галогеналкантиолы. Р-ции с HI приводят к бис-(2-гало-геналкил)дисульфидам. С HHal в р-рах ангидридов к-т олефинов тиооксиды превращаются в S-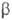 -галогеналкиловые эфиры тиолкарбо-новых к-т:
-галогеналкиловые эфиры тиолкарбо-новых к-т:
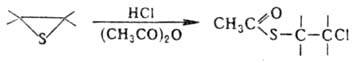
Аналогично протекает взаимод. с галогенидами Р(Ш) и As(III) в присут. ZnCl2.
Хлор и бром в безводных средах энергично раскрывают цикл олефинов тиооксидов с образованием b-галогеналкилсульфенилгало-генидов, а при избытке олефинов тиооксидов-бис-(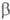 -галогеналкил)сульфидов; аналогично протекают р-ции с хлоридами серы, алкил-, арил- и ацилсульфенилхлоридами, напр.:
-галогеналкил)сульфидов; аналогично протекают р-ции с хлоридами серы, алкил-, арил- и ацилсульфенилхлоридами, напр.:
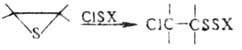
Алкил(реже арил)тиираны под действием гидридов металлов Li, Si, Sn или орг. соед. Li, Mg раскрывают цикл с образованием вторичных сульфидов, напр.:
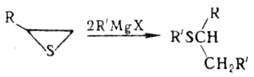
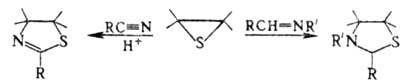
В присут. электрофилов или при нагр. олефинов тиооксиды вступают в р-ции с непредельными соед.: с нитрилами в присут. сильных к-т или к-т Льюиса образуют тиазолины, с азометинами и гидразонами -тиазолидины, напр.:
При нагр. в присут. катализаторов (бронза, комплексы нек-рых металлов), восстановлении, а также при взаимод. с фосфинами и фосфитами, тиокетенами (при УФ облучении), предшественниками карбенов или нитренов (напр., оксази-ридинами) олефинов тиооксиды десульфуризуются с образованием олефинов и серосодержащих соед., напр.:
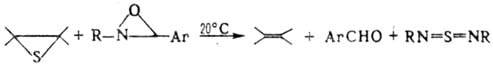
Р-ции осуществляются стереоспецифично.
Олефинов тиооксиды легко полимеризуются в условиях катионной и анионной полимеризации; сополимеризуются между собой, а также с акриловыми мономерами, алкилвиниловыми эфирами, олефинами и 1,3-диенами. Наиб. часто полимеризацию проводят в р-рах; катализатор - производные Zn или Cd, сокатализаторы - спирты, H2S, тиолы и дитиолы, амины, алкиленамины, NH3 .
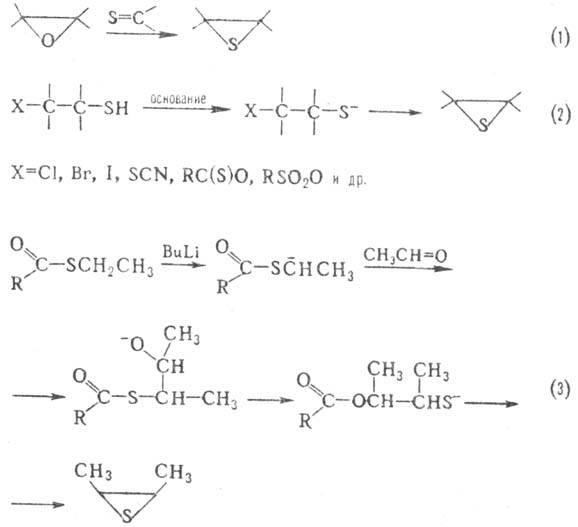
Осн. методы синтеза олефинов тиооксидов: замещение атома О оксиранов на атом S (тиолирование), осуществляемое действием KSCN, тиомочевины, тионов (р-ция 1); внутримол. конденсация р-замещенных тиолат-анионов (2 и 3); взаимод. тионов с диазоалканами (4); присоединение атомарной серы к олефинам (5):
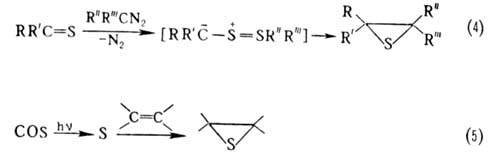
Олефинов тиооксиды используют в синтезе лек. ср-в, пестицидов, термостойких полимеров, антиоксидантов, модифицирующих добавок для кожезаменителей, резин, натуральных и синтетич. волокон. Низшие олефинов тиооксиды рекомендованы для одорации газов.
Олефинов тиооксиды мало- или среднетоксичны для теплокровных; токсичность возрастает с увеличением мол. массы олефинов тиооксидов.
Лит.: Фокин А. В., Коломиец А. Ф., Химия тииранов, М., 1978; Фокин А. В., Аллахвердиев М. А., Коломиец А. Ф., "Успехи химии", 1990. т. 59, в. 5, с. 705-737; Zoller U., в кн.: The chemistry of heterocyclic compounds, v. 42, pt 1, ed. by A. Hassner, N.Y., 1983, p. 330-630.
А. Ф. Коломиец.
