Алкоксисиланы и ароксисиланы
АЛКОКСИСИЛАНЫ И АРОКСИСИЛАНЫ [эфиры орто-кремниевой к-ты, алкил(арил)силикаты], соединения общих ф-л Si(OR)4 и Rn' Si(OR)4_n (замещенные алкоксисиланы и ароксисиланы), где R = Alk, Ar; R' = H, Alk, Ar, Hal и др.; п = 0-3 (см. табл.). Алкоксисиланы -бесцв. жидкости со слабым эфирным запахом. Ароксисиланы -бесцв. вязкие жидкости или кристаллы. Алкоксисиланы, содержащие группы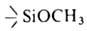
СВОЙСТВА АЛКОКСИСИЛАНОВ И АРОКСИСИЛАНОВ
| Соединение | Т. кип., °С/мм рт. ст. (т. пл., °С) | d420 | nD20 |
| Тетраметоксисилан Si(OCH3)4 | 121/760 (4.5) | 1,034 | 1.3688 |
| Тетраэтоксисилан Si(OC2H5)4 | 169/760 (-82) | 0.9335 | 1,3830 |
| Триэтоксисилан HSi(OC2H5)3 | 132/760 (-170) | 0.8753 | 1.3767 |
| Тстра-н-бутоксисилан Si(OC4H9)4 | 268/752 | 0,8990 | 1.4128 |
| TeTpa-трет-бутоксисилан Si(O-трет-C4H9)4 | 222/760 | 0,876 | 1,4028 |
| Хлортриэтокснсилан ClSi(OC2H5)3 | 157/765 | 1,0124 (при 25 °С) | 1,3884 (при 25 °С) |
| Днхлорлиэтоксисилан Cl2Si(OC2H5)2 | 138/754 | 1.1290 | |
| Трихлорэтоксисилан Cl3SiOC2H5 | 102/760 | 1 .2774 | 1.4045 |
| Метн.прнэтоксиснлан CH3Si(OC2H5), | 144/760 | 0,8948 | 1.3832 |
| Диметнлдиэтоксисилан (CH3)2Si(OC2H5)2 | 114/760 (-87) | 0.8395 | 1,3805 |
| Три мет ил этокснсилан (СН3)3SiOС2H5 | 76/760 | 0,7573 | 1.3742 |
| Виннлтриэтоксиснлан CH2=CHSi(OC2H5)3 | 161/760 | 0.9027 | 1,3960 (при 25 °С) |
| Фенилтриэтоке нейлан C6H5Si(OC2H5)3 | 235-238/760 | 0,9961 | 1,4718 |
| Метнлфеннлднметоксиснлан (CH3XC6H5)Si(OC2H5)2 | ок. 200/760 | 0,9934 | 1,4694 |
| Днфснилдиэтоксисилан (C6H5)2Si(OC2H5)2 | 296/760 | 1.0329 | 1.5268 |
| Тетрафеноксисилан Si(OC6H5)4 | 419/760 (49.5) | — | |
| Дифенилднфеноксисилан (С6Н5)2Si(ОС6Н5)2 | 230-235/4 (70-71) | — | |
| Дифсиилдиксилилоксисиланы (смесь изомеров) | 400-450/760 (т. заст. от - 10 | 1.1180 | 1.585 |
| (C6H5)2Si[OC6H3(CH3)2]2 | до -15 °С) |
или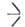 SiOC2H5, распадаются выше 200°С по р-ции: 2
SiOC2H5, распадаются выше 200°С по р-ции: 2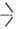 SiOR -> ROR +
SiOR -> ROR +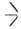 SiOSi
SiOSi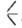 . С увеличением длины и (или) разветвленности алкильных радикалов термостабильность алкоксисиланов уменьшается; в продуктах их распада присутствуют насыщ. и ненасыщ. углеводороды. Ароксисиланы термостабильны до 370-420°С.
. С увеличением длины и (или) разветвленности алкильных радикалов термостабильность алкоксисиланов уменьшается; в продуктах их распада присутствуют насыщ. и ненасыщ. углеводороды. Ароксисиланы термостабильны до 370-420°С.
1. Гидролиз: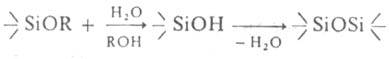 , где R = СН3, С2Н<, С6Н5. Катализаторы-к-ты, щелочи, амины, алкоголяты Af, Ti и др. Р-ция ускоряется в среде гомогенизирующего (смешивающегося с водой) р-рителя, напр. этанола, ацетона. Процесс экзотермичен. Полный гидролиз алкоксисиланов приводит к SiO2, частичный-к полиалкоксисилоксанам. Соед. с пространственно емкими орг. радикалами, напр. тетрабутокси- и днфенилдикрезоксисиланы, в обычных условиях не гидролизуются.
, где R = СН3, С2Н<, С6Н5. Катализаторы-к-ты, щелочи, амины, алкоголяты Af, Ti и др. Р-ция ускоряется в среде гомогенизирующего (смешивающегося с водой) р-рителя, напр. этанола, ацетона. Процесс экзотермичен. Полный гидролиз алкоксисиланов приводит к SiO2, частичный-к полиалкоксисилоксанам. Соед. с пространственно емкими орг. радикалами, напр. тетрабутокси- и днфенилдикрезоксисиланы, в обычных условиях не гидролизуются.
2. Переэтерификация: — SiOR + R'OH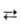 —SiOR'+ ROH (R'= Alk, Ar). Катализаторы -к-ты, алкоголяты щелочных металлов, Al, Fe или Ti, амины, амиды и др. Р-цию используют для замещения низших R на высшие, напр. при получении арилароксисиланов.
—SiOR'+ ROH (R'= Alk, Ar). Катализаторы -к-ты, алкоголяты щелочных металлов, Al, Fe или Ti, амины, амиды и др. Р-цию используют для замещения низших R на высшие, напр. при получении арилароксисиланов.
3. Силанолиз: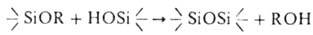 . На этой р-ции в присут. катализатора (октаноат Sn, диалкилдиацилоксистаннаны, цинковые, свинцовые, аммониевые соли орг. к-т) основана "холодная" вулканизация полисилоксандиолов при помощи алкоксисиланов, широко применяемая, напр., для отверждения герметиков.
. На этой р-ции в присут. катализатора (октаноат Sn, диалкилдиацилоксистаннаны, цинковые, свинцовые, аммониевые соли орг. к-т) основана "холодная" вулканизация полисилоксандиолов при помощи алкоксисиланов, широко применяемая, напр., для отверждения герметиков.
4. Взаимод. алкоксисиланов с металлоорг. соед., напр.: Si(OC2H5)4 + nRMgCl -> R,,Si(OC2H5)4-n + MC2H5OMgCl. Р-цию используют в пром-сти для синтеза алкил- и арилалкоксисиланов, последующим гидролизом к-рых в присут. НС1 получают полиорганосилоксаны. Катализирует р-цию исходный алкоксисилан. Алкилирующими агентами могут служить также литий-, цинк- и алюмшшйалкилы.
5. Гетерофункциональная конденсация алкоксисиланов по схеме:
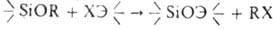 , где Э = Si, Sn, Ti и др.,
, где Э = Si, Sn, Ti и др.,
X = Cl, RCOO. В р-ции с хлор- и ацетоксисиланами катализаторы-H2SO4, HC1, FeCl3, A1C13, соед. Sn, алкоголяты Na и др.; т-ра-от комнатной до 200°С.
6. Обмен функц. групп, напр.: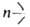 SiOR + ХnЭ-> n—SiX + (RO)n3, где Э = Si, В, Al, Ti и др., X = OR, Ar, Hal и др. Катализируют сильные к-ты, хлориды Fe и А1, соед. Sn и др.; с галогенидами В р-ция идет без катализатора при т-рах от - 120 до -70°С, с
SiOR + ХnЭ-> n—SiX + (RO)n3, где Э = Si, В, Al, Ti и др., X = OR, Ar, Hal и др. Катализируют сильные к-ты, хлориды Fe и А1, соед. Sn и др.; с галогенидами В р-ция идет без катализатора при т-рах от - 120 до -70°С, с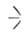 SiAr-в присут. щелочного катализатора при 150-230 °С. Склонность к обмену групп OR тем меньше, чем больше разветвленность R и число заместителей у Si.
SiAr-в присут. щелочного катализатора при 150-230 °С. Склонность к обмену групп OR тем меньше, чем больше разветвленность R и число заместителей у Si.
7. Расщепление по связям О—С при действии щелочных металлов, их гидроксидов или алкоголятов, карбоновых и неорг. к-т, их ангидридов, а в присут. сильных к-т-при действии простых и сложных эфиров, альдегидов, кетонов.
Осн. метод синтеза алкоксисиланов-этерификация хлорсиланов спиртами при 20-40°С (на завершающей стадии-при т-ре кипения спирта): SiCl + HOR
SiCl + HOR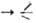 SiOR + HC1. Спирт обычно берут с избытком 5-10%. Побочный процесс - взаимод. спирта и НС1 с образованием хлоралкила и воды, к-рая ги-дролизует хлор- и алкоксисиланы до силоксанов.
SiOR + HC1. Спирт обычно берут с избытком 5-10%. Побочный процесс - взаимод. спирта и НС1 с образованием хлоралкила и воды, к-рая ги-дролизует хлор- и алкоксисиланы до силоксанов.
Группы ОСН3 и ОС2Н5 определяют р-цией алкоксисиланов с НI-к-той и послед, анализом RI методом бромометрии или ГЖХ, алкоксигруппы до С8-ацетилированием алкоксисиланов уксусным ангидридом и титрованием избытка ангидрида р-ром щелочи. Методы определения ароксигрупп-потенциометрич. титрование ароксисилана р-ром (C4H9)2NOH в смеси диэтиламина с ацетоном или гидролиз ароксисиланов с послед. определением фенола кулонометрич. титрованием с применением электрогенерированного брома.
Алкоксисиланы используют в синтезе др. кремнийорг. продуктов; напр., из тетраэтоксисилана получают алкил(арил)этоксисиланы, из триэтоксисилана-фтор-, амино- и цианорганоэтоксисиланы, из винилтриэтоксисилана (по р-ции Арбузова) -фосфоркремнийорг. соединения. Алкоксисиланы служат также вулканизующими агентами для кремнийорг. и др. полимеров (напр., тетраэтоксисилан), аппретами наполнителей композиц. полимерных материалов (напр., винилтриэтоксисилан, аминорганоэтоксисиланы). Арокси- и арилароксисиланы-теплоносители, используемые при температурах до 400°С.
Алкоксисиланы токсичны, имеют скрытый период действия, обладают кумулятивными св-вами. ПДК (мг/м3): для тетраэтоксисилана-20, для тетраметоксисилана-5, для триэтоксисилана-1. ЛД50 (мг/кг; мыши, перорально): для метилфенилдиметоксисилана - 680, для дифенилдиксилилоксисилана - 40 000.
См. также Тетраэтоксисилан. Об олигомерных эфирах ортокремниевой к-ты см. Этилсиликаты, об аминоорганоалкоксисиланах и ацетоксисиланах - Кремний органические соединения.
Литература
АН д риано в К. А., в кн.: Методы элементоорганической химии. Кремний, под ред. А. Н. Несмеянова и К. А. Кочешкова, М., 1968. с. 175-201; Воронков М. Г., Мнлешкевич В. П., Южелевский Ю. А.. Силоксановая связь, Новосиб., 1976. с. 188-317; X анана ш ви л и Л. М.. Андрианов К.А.. Технология элементоорганнческнх мономеров и полимеров, 2 изд., М., 1983, с. 92-130. Е.А. Чернышев, А.С. Шапатин.
