Никельорганические соединения
НИКЕЛЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат связь Ni—С. Связь Ni с орг. лигандом может осуществляться по s- и p-типу (соотв. s- и p-комплексы).
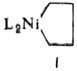
s-К о м п л е к с ы. Соед. Ni с s-связью Ni—С относятся в осн. к типам [Ni(R2)L2] и [NiX(R)L2] (R = Alk или Аr, L = PR'3, амины и др., Х-ацидолиганд), имеющим строение плоского квадрата С транс-расположением лигандов (см. Координационные соединения). Для них характерны р-ции обмена ацидо- и донорных лигандов с сохранением связи Ni—С, а также р-ции замещения группы R и р-ции внедрения СО и алкинов по связи Ni—С. Соед. [Ni (acac)(R)L] (R = Alk, асас-ацетилацетонат-анион) обычно получают восстановлением Ni(acac)2 с помощью орг. соед. Аl в присут. PR3; они также образуются при взаимод. [Ni (acac)(Н)L] с алкенами. Эту р-цию рассматривают как первую стадию димеризации алкенов в присут, гидридов Ni. Бинарные никельорганические соединения типа [NiR2] крайне неустойчивы, их удается выделить только для соед. с объемным R при отсутствии в R b-атомов Н, как, напр., в бис-(мезитил)никеле; известны перфторалкильные никельорганические соединения, напр. [Ni(C6F5)2]. Присоединение карбаниона к [NiR2] приводит к солеобразным комплексам (никелат-комплексам) [NiR4]2-, напр. K2[Ni(C=CR)4], [N(C4H9)4]2 x х [Ni(C6H5)4]. К соед. с s-связью Ni—С относятся также никелациклопeнтановые комплексы (ф-ла I)-промежут. соед. при димеризации напряженных алкенов.
p-К о м п л е к с ы. Алкеновые и полиеновые никельорганические соединения, содержащие Ni в нулевой степени окисления, имеют тригональную или тетраэдрич. структуру. Эти соед. весьма чувствительны к действию О2 воздуха; вступают в р-ции окислит. присоединения и обмена лигандов. Восстановлением соли Ni орг. соед. Аl в присут. 1,5,9-циклододекатриена (cdt)получен тригон. комплекс [Ni(cdt)], имеющий транс, транс, транс-конфигурацию. Это никельорганическое соединение-исходное в-во для синтеза неустойчивых олефиновых комплексов, напр.:
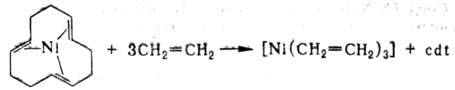
Известны также h2-алкеновые комплексы [NiL2(алкен)], стабилизированные донорными лигандами (о значении символа h см. Гапто-). Их получают замещением алкена на донорный лиганд или замещением донорного лиганда на алкен, напр.:
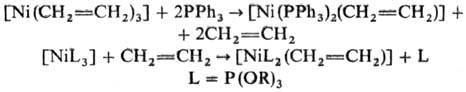
Из тетраэдрич. комплексов Ni наиб. важен бис-(1,5-цикло-октадиен)никель [Ni(cod)2], к-рый широко используется как реагент в химии никельорганических соединений и в орг. синтезе. Известно также большое число комплексов Ni, содержащих a,b-нена-сыщ. альдегиды и кетоны, сложные эфиры, нитрилы, пер-фторалкены, дурохинон (тетраметил-1,4-бензохинон). Среди них - бис-(акрилонитрил)никель, получаемый р-цией [Ni(CO)4] с CH2=CHCN, к-рому приписывают полимерное строение.
Никель образует h2-алкиновые комплексы. Осн. тип моноядерных комплексов- [NiL2(RC=CR)], имеющих плоское тригон. строение. Их получают замещением нек-рых лигандов в никельорганических соединениях на алкин, напр.:
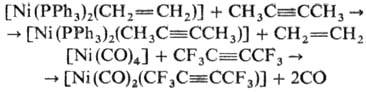
В биядерных и кластерных комплексах Ni молекула ал-кина часто играет роль мостикового лиганда, напр.:
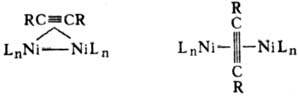
Подробно изучены h3-аллильные комплексы [Ni(h3-ал-лил)2]. Эти соед. чрезвычайно чувствительны к действию О2 воздуха, в присут. к-рого самовозгораются. Для них характерны h3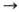 h1-перегруппировки, протекающие под действием донорных лигандов:
h1-перегруппировки, протекающие под действием донорных лигандов:
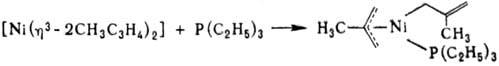
При взаимод. с избытком донорного лиганда аллильные группы полностью замещаются, при р-ции со спиртами и галогеноводородами возможно замещение одного аллиль-ного лиганда, в р-циях с Fc2(CO)9 или PdCl2 происходит перенос h3-аллильной группы с Ni на др. металлы, напр.:
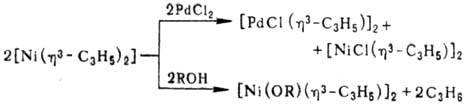
Соед. [Ni(h3-аллил)2] получают р-цией NiHal2 с ал-лилмагнийгалогенидами или диспропорционированием [{NiХ(h3-аллил)}2] под действием координирующих р-рителей (NH3, ДМФА, Н2О и др.):
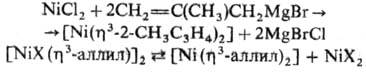
Соед. [NiХ(h3-аллил)]2 м. б. получены окислит. присоединением аллильных производных к комплексам Ni(0), напр.:
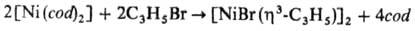
При взаимод. [Ni(cdt)] с 1,3-бутадиеном образуется бисал-лильное никельорганическое соединение:
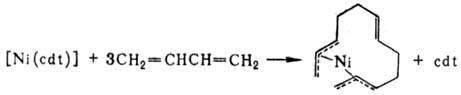
Образующийся в р-ции [Ni(h3,h3-C12Hl8)] может реагировать далее с донорным лигандом с замыканием цикла, давая [NiL(cdt)]. Аналогично протекает р-ция [Ni(cod)2] с бутадиеном в присут. донорных лигандов:
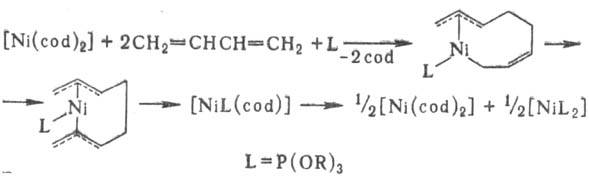
Эти р-ции рассматривают как модельные для изучения каталитич. циклоолигомеризации диенов на комплексах Ni(0).
Для комплексов Ni с циклобутадиеном характерны р-ции с нуклеоф. реагентами с образованием h3-циклобутениль-ных комплексов, перенос циклобутадиенового комплекса с Ni на др. металлы при взаимод. с карбонилами металлов; возможно также восстановление комплексов Ni(II) до комплексов Ni(0) в присут. донорных лигандов:
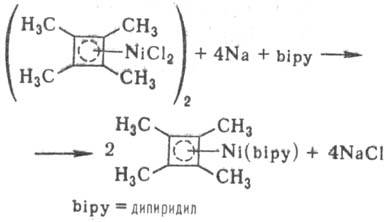
Получают циклобутадиеновые комплексы дегалогениро-ванием 3,4-дигалогенопроизводных тетразамещенного цик-лобутена в присут. [Ni(CO)4], переносом циклобутадиенового лиганда с Pd на Ni, а также р-циями NiHal2 с алкинами.
Из циклопентадиенильных комплексов Ni наиб. важен кристаллич. никелоцен [Ni(h-C5H5)2], постепенно разлагающийся на воздухе; парамагнитен. Для него характерны р-ции по связям металл-цикл (напр., при действии восстановителей, оснований и к-т), р-ции замещения и присоединения в одном из циклов, напр.:
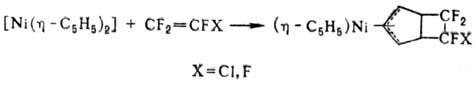
Никелоцен легко окисляется в р-рах до монокатиона [Ni(h-C5H5)2]+; электрохимически можно получить ступенчато моно- и дикатионы. Никелоцен - исходное в-во практически для всех моноциклопентадиенильных комплексов Ni:
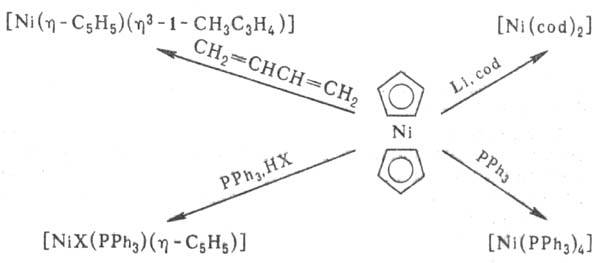
Осн. способ получения никелоцена- р-ция солей Ni с циклопентадиенидами щелочных металлов или Тl.
h-Ареновые комплексы нетипичны для Ni. Наиб. изучен комплекс [Ni{h-C6(CH3)6}2]2+(AlBr4)2, образующийся при взаимод. NiBr2 с гексаметилбензрлом в присут. АlВr3. Соконденсацией в паровой фазе Ni со смесью бромпента-фторбензол-толуол синтезирован [Ni(C6F5)2(h-CH3C6H5)].
Никельорганические соединения широко применяют в гомогенном и гетерогенном катализе. Так, алкеновые и полиеновые комплексы Ni(0)-эффективные катализаторы линейной олигомеризации и гидросилилирования олефинов, циклоолигомеризации и изомеризации диенов; аллильные никельорганические соединения вызывают цикло-олигомеризацию бутадиена, а в присут. добавок (фосфины, орг. соед. Аl)-линейную олигомеризацию ненасыщ. углеводородов. бис-(Аллил)никель на SiО2-кат. гидрирования и полимеризации бутадиена. Нек-рые никельорганические соединения, напр. [Ni(cod)2] и [Ni(h-C5H5)2], используют для получения металлич. покрытий.
Лит.: Методы элементоорганической химии. Кобальт, никель, платиновые металлы, под общ. ред. А. Н. Несмеянова, К. А. Кочешкова, М., 1978, с. 128-245; Jolly P. W., Nickel, в кн.: Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 6, Oxf., 1982. Л. С. Исаева.
