Реакции в твердых телах
РЕАКЦИИ В ТВЕРДЫХ ТЕЛАХ, р-ции, протекающие в потенц. поле решетки, образуемой частицами твердого тела. Реагирующие частицы (хим. подсистема) могут находиться в узлах упорядоченной структуры (кристалл) или неупорядоченной структуры (аморфное твердое тело), а также в междоузельном пространстве. В рамках активированного комплекса теории движение хим. подсистемы вдоль координаты реакции по пов-сти своб. энергии сопровождается изменением состояния решетки (переориентацией частиц), аналогичным реорганизации среды, т. е. изменению положения и ориентации молекул р-рителя при реакциях в растворах. Особенностью реакций в твердых телах является неравновесный характер взаимод. хим. подсистемы со средой: характеристич. время тх, связанное с движением хим. подсистемы, намного меньше характеристич. времени тq, определяющего переориентацию частиц в решетке, вследствие чего реакции в твердых телах сопровождаются появлением в среде мех. деформаций. Константа скорости ks реакций в твердых телах определяется выражением:
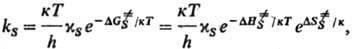
где 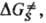
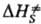 и DS.-соотв. изменения энергии Гиббса, энтальпии и энтропии хим. подсистемы при переходе к переходному состоянию (ПС), или своб. энергия активации, энтальпия активации и энтропия активации р-ции, xs ! 1 -трансмиссионный множитель, расчет к-рого выходит за рамки теории активир. комплекса, к и h-постоянные Больц-мана и Планка соотв., Т-абс. т-ра. В наиб. простом случае р-ции в бездефектном плотноупакованном кристалле, где реагирующие частицы расположены в узлах решетки, как правило, осн. вклад в
и DS.-соотв. изменения энергии Гиббса, энтальпии и энтропии хим. подсистемы при переходе к переходному состоянию (ПС), или своб. энергия активации, энтальпия активации и энтропия активации р-ции, xs ! 1 -трансмиссионный множитель, расчет к-рого выходит за рамки теории активир. комплекса, к и h-постоянные Больц-мана и Планка соотв., Т-абс. т-ра. В наиб. простом случае р-ции в бездефектном плотноупакованном кристалле, где реагирующие частицы расположены в узлах решетки, как правило, осн. вклад в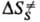 дает изменение колебат. энтропии кристалла при образовании ПС, к-рое настолько незначительно, что в первом приближении величиной
дает изменение колебат. энтропии кристалла при образовании ПС, к-рое настолько незначительно, что в первом приближении величиной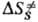 можно пренебречь. Величина
можно пренебречь. Величина 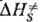 включает в себя изменение энтальпии хим. подсистемы
включает в себя изменение энтальпии хим. подсистемы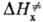 , рассматриваемой изолированно, и изменение энтальпии
, рассматриваемой изолированно, и изменение энтальпии , обусловленное мех, деформациями решетки:
, обусловленное мех, деформациями решетки:
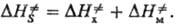
В зависимости от взаимной ориентации реагирующих частиц и остальных частиц решетки возможны разл. конфигурации ПС (разл. пути р-ции) и соотв. разная структура образующегося продукта. В плотноупакованном бездефектном кристалле решетка, окружающая хим. подсистему, может считаться абсолютно хлесткой и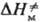 представляет собой изменение энтальпии лишь вследствие деформации связей реагирующих частиц с фиксир. решеткой. Эта величина определяется в осн. силами отталкивания, к-рые экспоненциально увеличиваются по мере усиления деформации связей. Поэтому, если ПС по своей конфигурации сильно отличается от исходного состояния хим. подсистемы, на пути р-ции возникает чрезвычайно высокий барьер. Оценки на основе метода атом-атомных потенциалов (см. Молекулярная механика)показывают, что реакции в твердых телах протекают лишь в тех случаях, если при переходе к ПС межатомные расстояния "спрессовываются" не более чем на 30-40%. В большинстве кристаллов возможный путь р-ции и соотв. структура продукта однозначно определяются условием минимума
представляет собой изменение энтальпии лишь вследствие деформации связей реагирующих частиц с фиксир. решеткой. Эта величина определяется в осн. силами отталкивания, к-рые экспоненциально увеличиваются по мере усиления деформации связей. Поэтому, если ПС по своей конфигурации сильно отличается от исходного состояния хим. подсистемы, на пути р-ции возникает чрезвычайно высокий барьер. Оценки на основе метода атом-атомных потенциалов (см. Молекулярная механика)показывают, что реакции в твердых телах протекают лишь в тех случаях, если при переходе к ПС межатомные расстояния "спрессовываются" не более чем на 30-40%. В большинстве кристаллов возможный путь р-ции и соотв. структура продукта однозначно определяются условием минимума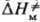 . Такие реакции в твердых телах относятся к топонимическим реакциям. Др. тип реакций в твердых телах характерен для пластичных кристаллов, образованных квазисферич. или квазицилинд-рич. молекулами, в к-рых барьеры переориентации частиц решетки при образовании ПС невысоки и поэтому возможны разные пути р-ции и соотв. различные по структуре продукты.
. Такие реакции в твердых телах относятся к топонимическим реакциям. Др. тип реакций в твердых телах характерен для пластичных кристаллов, образованных квазисферич. или квазицилинд-рич. молекулами, в к-рых барьеры переориентации частиц решетки при образовании ПС невысоки и поэтому возможны разные пути р-ции и соотв. различные по структуре продукты.
Влияние кристаллич. структуры на структуру продукта м. б. проиллюстрировано на примере термич. димеризации изоцианатных групп, единств. продукт р-ции в кристалле-напряженные 4-членные азетидиновые циклы. В р-ре такие циклы не образуются, а возникают более стабильные 6-член-ные кольца:
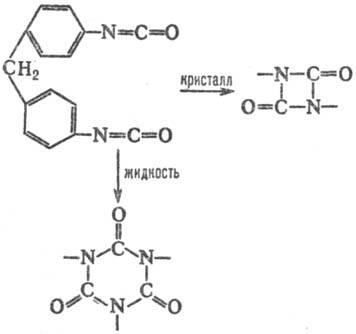
Формирование таких колец при димеризации в кристаллич. фазе требует значит. переориентации частиц решетки и поэтому полностью заторможено. Частичное превращение хим. энергии в энергию напряжения 4-членных азетиди-новых циклов обусловлено отсутствием релаксации среды. В области дефектов кристаллич. структуры, где плотная упаковка нарушается и. появляется нек-рый своб. объем, становится возможным изменение ориентации частиц и нарушается корреляция между конфигурациями исходного состояния хим. подсистемы, ПС и продукта. Если ПС образуется в своб. объеме дефекта, то, в отличие от р-ций в бездефектном кристалле,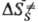 > 0, поскольку при образовании ПС появляются дополнит. степени свободы. Во мн. случаях молярный объем продукта меньше молярного объема реагирующей подсистемы, что приводит к изменению структуры продукта. Напр., при твердофазной полимеризации структура образующихся в начале процесса полимерных цепей определяется лишь структурой решетки, но по мере увеличения конверсии мономера и "разрыхления" кристалла структура цепей постепенно приближается к той, к-рая характерна для жидкофазной полимеризации.
> 0, поскольку при образовании ПС появляются дополнит. степени свободы. Во мн. случаях молярный объем продукта меньше молярного объема реагирующей подсистемы, что приводит к изменению структуры продукта. Напр., при твердофазной полимеризации структура образующихся в начале процесса полимерных цепей определяется лишь структурой решетки, но по мере увеличения конверсии мономера и "разрыхления" кристалла структура цепей постепенно приближается к той, к-рая характерна для жидкофазной полимеризации.
Изменение константы скорости р-ции при переходе от жидкой среды к равновесному кристаллу определяется отношением:
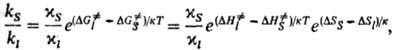
где индексами S и / обозначены соответствующие величины при р-ции в кристалле и в клетке, образованной молекулами р-рителя (см. Клетки эффект). В первом приближении для маловязких сред можно считать 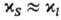 . Поскольку кристалл, в отличие от жидкой среды, не подстраивается к хим. подсистеме в процессе образования ПС, реакции в твердых телах связаны с преодолением более высокого потенц. барьера, чем аналогичные р-ции в жидкости. Напр., рекомбинация радикальных пар в р-ре является практически безактива-ционной, а в кристалле требует значит. энергии активации. В случае мономолекулярных р-ций, константы скорости к-рых определяются в осн. энергетич. факторами, а не энтропийными, можно ожидать замедления р-ций в кристалле. Для бимолекулярных р-ций следует учитывать и энтропийный фактор; в первом приближении
. Поскольку кристалл, в отличие от жидкой среды, не подстраивается к хим. подсистеме в процессе образования ПС, реакции в твердых телах связаны с преодолением более высокого потенц. барьера, чем аналогичные р-ции в жидкости. Напр., рекомбинация радикальных пар в р-ре является практически безактива-ционной, а в кристалле требует значит. энергии активации. В случае мономолекулярных р-ций, константы скорости к-рых определяются в осн. энергетич. факторами, а не энтропийными, можно ожидать замедления р-ций в кристалле. Для бимолекулярных р-ций следует учитывать и энтропийный фактор; в первом приближении 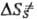 —
—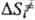 ! — DSпл, где DSпл-энтальпия плавления кристалла. Энтропийная составляющая изменения энергии Гиббса системы, в отличие от энергетической, приводит к увеличению отношения констант скорости ks/kl.
! — DSпл, где DSпл-энтальпия плавления кристалла. Энтропийная составляющая изменения энергии Гиббса системы, в отличие от энергетической, приводит к увеличению отношения констант скорости ks/kl.
Влияние на скорости реакций в твердых телах величины мех. деформации при образовании ПС м. б. понято на примере термич. изомеризации n-диметилбензолсульфоната (ДМБС) в результате межмол. переноса метильной группы:
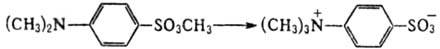
В решетке кристалла реагирующие атомные группы (CH3)2N и SО3СН3 тесно контактируют друг с другом; энергия мех. деформаций, как подтверждают расчеты, мала. Поэтому осн. вклад в константу скорости дает энтропийный член, что обусловливает значит. ускорение р-ции и в кристалле в сравнении с жидкой фазой. Если же при реакциях в твердых телах мех. деформации велики, становится определяющим энергетич. член в выражении для константы скорости kS и бимолекулярная р-ция замедляется. Однако решетка может рассматриваться как равновесная лишь в самом начале р-ции. По мере развития мех. деформаций меняются условия для р-ции, что сказывается на ее кинетике. Это особенно важно для цепных твердофазных р-ций, поскольку последоват. акты роста цепи происходят в соседних ячейках кристалла и связаны друг с другом не только химически, но и механически. Напр., полимеризация диацетиленов эффективно протекает в кристаллич. состоянии, а в жидкой фазе практически не идет. В соответствии со структурой мономерного кристалла первичная димеризация молекул с образованием бирадикала в равновесной кристаллич. ячейке в условиях заторможенной релаксации решетки приводит к превращению части хим. энергии в энергию мех. деформаций. Это, в свою очередь, приводит к продвижению радикальных центров по координате р-ции в следующих актах роста цепи. Радикальный центр оказывается в деформированной sp2-конфигурации, к-рая, как показывают квантовохим. расчеты, более реакционноспособна, чем равновесная линейная sp-конфигурация. Рост цепи сопровождается движением фронта локальной мех. деформации, сильно понижающей энергию активации роста цепи.
Константы скорости реакций в твердых телах однозначно м. б. определены только применительно к идеальному кристаллу. В реальном кристаллич. в-ве со множеством дефектов (вакансии, дислокации, границы зерен в поликристаллах и т.д.) Реакции в твердых телах характеризуются многими константами скорости ki к-рые определяются локальным окружением реагирующих частиц в i-й области кристалла. Эффективная константа скорости kэфф = Sziki, где zi-объемная доля i-й области. В-во в более реакционноспособных областях расходуется быстрее, чем в остальных, поэтому kэфф меняется в ходе р-ции. Такая кинетика наз. полихронной.
Аморфные (стеклообразные) твердые тела имеют неравновесную структуру, возникающую при быстром охлаждении жидкости или быстрой конденсации паров. В таких телах существуют "замороженные" участки своб. объема, где условия для р-ции приближаются к условиям в жидкости, т.е. возможна реорганизация среды. С др. стороны, в аморфных твердых телах существуют кластеры из плотно-упакованных молекул, близкие по структуре к кристаллич. фазе. Р-ции в кластерах по своей кинетике и механизму приближаются к реакциям в твердых телах и приводят к образованию метастабильных упорядоченных структур продуктов.
Реакции в твердых телах широко распространены в природе и используются в хим. технологии. Важнейшие из них: изменение состава горных пород под действием воды, кислорода воздуха, организмов и т.п. (хим. выветривание); образование и превращение минералов; р-ции, протекающие при обжиге, получении цементов; получение катализаторов; деструкция и окисление полимерных материалов; окисление металлов и сплавов; синтез тугоплавких и термостойких материалов; горение и взрывы твердых ВВ. В совр. микроэлектронике на реакциях в твердых телах основана, по сути дела, вся технология изготовления резистов. Важнейшее направление - модификация полимерных материалов и создание на этой основе новых в-в со св-вами металлов и полупроводников (см. Химия твердого тела).
Лит.: Китайгородский А. И., Молекулярные кристаллы, М., 1971; Третьяков Ю. Д., Твердофазные реакции, М., 1978; Браун М., Долли-мор Д., Галвей Л., Реакции твердых тел, пер. с англ., М., 1983; Воldуrev V., Bulens M., Delmon В., The control of the reactivity of solids, Amst., 1979; Gavezzotti A., Simonetta M., "Chem. Rev.", 1982, v. 82, № 1, p. 1-13.
Г. Н. Герасимов.
