Циклоолефины
ЦИКЛООЛЕФИНЫ (циклоалкены, циклены), ненасыщ. моноциклич. углеводороды общей ф-лы СnН2n_2. Циклоолефины и их производные относятся к алициклическим соединениям. По числу атомов С в цикле циклоолефинов подразделяют на малые (3 и 4 атома), обычные (5-7), средние (8-12) и большие (13 и более). Названия циклоолефинов образуют из названий соответствующих циклоалканов, заменяя окончание "ан" на "ен", напр. циклооктен.
Многие природные соед.- функциональные производные циклоолефинов. Так, из масла семян Sterculia foetida выделена стеркуловая к-та [8-(2-октилциклопропенил)октановая к-та], из губки Calyx nicadensis - калистерол - производное холестерина, содержащее в молекуле циклопропеновое кольцо. Из прир. источников выделен также антибиотик пинитрицин (гидроксиметилциклопропенон); один из распространенных орг. объектов в космич. пространстве - карбен циклопропенилиден.
Низшие циклоолефины- циклопропен и циклобутен - газы, остальные циклоолефины- жидкости (табл.), не раств. в воде, хорошо раств. в большинстве орг. р-рителей (углеводороды, спирты, простые и сложные эфиры). Жидкие циклоолефины часто образуют азеотропные смеси с разл. соед., напр. для циклогексена известны азеотропные смеси с водой, метанолом, этанолом, уксусной к-той, бензолом.
СВОЙСТВА НЕКОТОРЫХ ЦИКЛООЛЕФИНОВ
| Соединение | Мол.м. | Т.пл., °С | Т.КИП., °С | 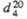 | 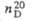 |
| Циклопропен | 40,06 | _ | -36 | _ | _ |
| Циклобутен | 54,09 | _ | 2,0 | 0,732 | _ |
| 68,11 | -135,1 | 44,2 | 0,7720 | 1,4225 | |
| Циклогексен | 82,14 | -103,51 | 82,98 | 0,8102 | 1,4465 |
| Циклооктен транс- | 110,19 | -59 | 143 | 0,8472 | 1,4741* |
| цис- | То же | -12 | 138 | 0,8472 | 1,4698 |
| Циклододецен | 166,30 | — | 100-103** | — | 1,4864 |
*При 25 oС. **При 11 мм рт. ст.
Особенности строения циклоолефинов (размер цикла и геометрия фрагмента С = С) м. б. выявлены с помощью спектров ПМР: хим. сдвиг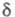 7,01 (=СН) и 0,92 (=ССН2) м. д. для циклопропена, 6,03 и 2,57 м.д. для циклобутена, 5,60 и 2,28 м.д. для циклопентена, 5,59 и 1,96 м. д. для циклогексена, 5,56 и 2,11 м.д. для циc-циклооктена, для транс-циклооктена хим. сдвиг
7,01 (=СН) и 0,92 (=ССН2) м. д. для циклопропена, 6,03 и 2,57 м.д. для циклобутена, 5,60 и 2,28 м.д. для циклопентена, 5,59 и 1,96 м. д. для циклогексена, 5,56 и 2,11 м.д. для циc-циклооктена, для транс-циклооктена хим. сдвиг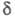 5,40 м. д. (=СН).
5,40 м. д. (=СН).
В отличие от транс-олефинов, обладающих большей стабильностью, чем соответствующие цис-изомеры, относит. стабильность цис- и транс-циклоолефинов меняется в зависимости от размера цикла. Для малых и обычных циклов стабильны лишь цис-изомеры, к-рые можно выделить в индивидуальном состоянии; транс-изомеры С3 - С7 обладают значительно большим запасом энергии и потому более реакционноспособны. Начиная с циклооктена с увеличением размера цикла стабильность транс-изомеров увеличивается. Кроме того, у таких циклоолефинов появляется хиральность. Так, разделение рацемич. транс-циклооктена с помощью платиновых комплексов, содержащих оптически активный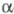 -фенилэтиламин, приводит к достаточно стабильным D- и L-энантиомерам: активац. барьер рацемизации 149,07 кДж/моль. Стабильность энантиомеров транс-циклононена и транс-циклодецена невысока из-за значительно большей конформац. подвижности полиметиленовых цепочек.
-фенилэтиламин, приводит к достаточно стабильным D- и L-энантиомерам: активац. барьер рацемизации 149,07 кДж/моль. Стабильность энантиомеров транс-циклононена и транс-циклодецена невысока из-за значительно большей конформац. подвижности полиметиленовых цепочек.
Реакц. способность циклоолефинов, изменяющаяся в широких пределах, определяется размером цикла, его конформац. особенностями и изомерией относительно связи С = С. наиб. реакционноспособны циклопропен и циклобутен благодаря высокой энергии напряжения малого цикла (см. Напряжение молекул). Так, циклопропен, его моно-и многие 1,3-дизамещенные производные вступают в еновые реакции при низких т-рах (р-ция 1); легко металлируются под действием оснований (литийорг. соед., амиды металлов и др.) при наличии хотя бы одного атома Н у атомов С-1 или С-2 (2); образуют соли циклопропенилия в результате отрыва галогена или гидрид-иона от атома С-3 циклопропенов (3); в условиях термич., каталитич. и фотохим. р-ций способны генерировать алкенилкарбены (4):
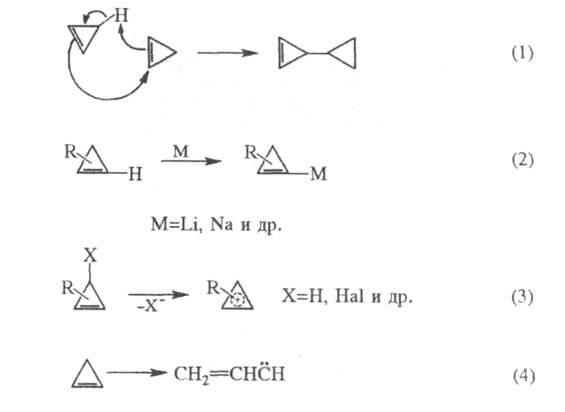
Циклобутен при нагр. до 180 °С изомеризуется количественно в 1,3-бутадиен. Такое раскрытие производных циклобутена часто используют для синтеза разнообразных 1,3-диенов. Особый интерес представляют стереоселективные превращения 3,4-дизамещенных циклобугенов в 1,4-дизамещенные 1,3-бутадиены:
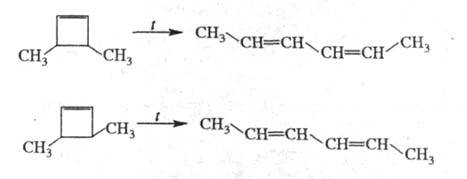
Циклоолефины вступают в р-ции каталитич. гидрирования, присоединяют галогены, окисляются надкислотами с образованием соотв. циклоалканов, 1,2-дигалогенпроизводных и эпоксидов:
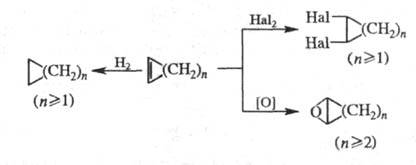
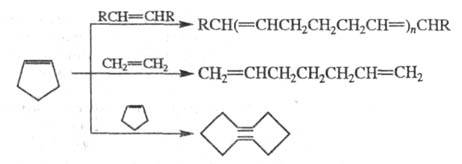
В условиях р-ций метатезиса циклоолефины расщепляются, образуя ациклич. полимерные, мономерные и циклич. продукты, напр.:
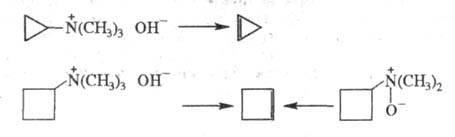
Циклоолефины получают с помощью р-ций элиминирования, используя доступные замещенные циклоалканы. Так, циклопропен и циклобутен получают термич. разложением четвертичных аммониевых оснований в условиях р-ции Гофмана либо термич. разложением N-оксидов третичных аминов:
Циклопропены м. б. получены также присоединением карбенов по связям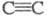 (см. Карбены). Для синтеза замещенных циклобутенов используют внутри- или межмол. фотохим. [2 + 2]-циклоприсоединение производных этилена и ацетилена:
(см. Карбены). Для синтеза замещенных циклобутенов используют внутри- или межмол. фотохим. [2 + 2]-циклоприсоединение производных этилена и ацетилена:
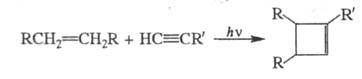
Циклопентен и циклогексен получают обычно дегидратацией соответствующих циклоалканолов, используя в качестве дегидратирующих средств А12О3 или силикагель при повышенных т-рах, а в лаборатории - H2SO4 либо Н3РО4. Циклопентен м. б. получен гидрированием циклопентадиена на Pd-катализаторах.
Для синтеза циклооктена и циклододецена используют селективное гидрирование соотв. 1,5-циклооктадиена и 1,5,9-циклододекатриена в присут. Ni-катализаторов.
Циклоолефины- полупродукты в орг. синтезе. Циклопентен - сырье для получения каучука, циклогексен - алкилирующий агент, р-ритель, применяется для синтеза малеиновой, адипиновой, циклогексанкарбоновой к-т и циклогексанкарбальдегида; в лаборатории - для синтеза бутадиена.
См. также Циклопентен.
Лит.: Марч Дж., Органическая химия, пер. с англ., т. 1987-88; McQuillin F. J., Alicyclic chemistry, Camb., 1972; GuntherH., Gunther J., "Chem. Rev.", 1977, v. 77, № 4, p. 599-637; Winnacker K., KuchlerL., Chemische Technologic, 4 Aufl., Bd 5, Munch., 1984; Chemistry of the cyclopropyl group, ed. Z. Rappoport, pt. 1, L., 1987, p. 101-172.
И. Г. Болесов.
