Стекло неорганическое
СТЕКЛО НЕОРГАНИЧЕСКОЕ, твердый аморфный материал, получающийся в результате переохлаждения жидкости (напр., расплава неорг. оксидов, водного р-ра солей, жидкого металлич. сплава). Обладает мех. св-вами твердого тела, характеризуется термодинамич. метастабильностью; при определенных условиях склонно к кристаллизации. Отличается от кристаллов и жидкостей: стекло неорганическое рентгеноаморфно вследствие неупорядоченного атомного строения (в его структуре отсутствует дальний порядок), изотропно, не имеет определенной т-ры затвердевания или плавления, т. е. при охлаждении расплав переходит из жидкого состояния сначала в пластичное, а затем в твердое (процесс стеклования). Процессы нагревания и охлаждения (если при охлаждении не происходит кристаллизации) обратимы. Температурный интервал Tf - Тg, в пределах к-рого происходят эти процессы, наз. интервалом стеклования (Tf-т-ра перехода из жидкого состояния в пластичное, Тg-т-ра перехода из пластичного состояния в твердое). Интервал стеклования (обычно 100-200 °С) зависит от хим. состава и скорости охлаждения стекла неорганического и представляет собой переходную область, в пределах к-рой происходит резкое изменение его св-в. В стекле неорганическом существуют образования (рои, кластеры или атомные комплексы) с размерами от 0,5 до 2 нм и разл. включения технол. или ликвационного происхождения от 5,0 до 100,0 нм.
Классификация стекол. Стекла неорганические различают по составу и назначению. По составу выделяют одно- или многокомпонентные стекла неорганические, состоящие из разл. элементов (металлы, неметаллы), галогенидов, халькогенидов, оксидов и др. Од-нокомпонентные элементные стекла неорганические способны образовывать небольшое число неметаллов - S, Se, As, P, С и нек-рые металлы-Bi, Ca, Zn, Hf, V, Nb, Та, Сr, Mo, W, Re, Fe, Ni, Al и др. Однокомпонентные галогенидные стекла неорганические получают гл. обр. на основе стеклообразующего компонента-BeF2, ZrF4 или BaF2; многокомпонентные составы фторберилатных стекол содержат также фториды Al, Ga, Mg, Sr, Ba. Многокомпонентные промышленные стекла неорганические на основе хлоридов, бромидов и иодидов разл. металлов могут иметь след. состав (% по массе): КХ 0-24.С, РbХ 0-24,0, SrX 2,0-30,0, CdX 34,0-53,0, ВаХ 8,0-40,0, РbХ2 0-23,0 (X = Cl, Br, I). Халькогенидные стекла неорганические содержат бескислородные системы типа As-X, Ge-As-X, Ge-Sb-X, Ge-P-X, где X = S, Se, Те. Состав пром. халькогенидных стекол неорганическох (% по массе): Те 85,0-87,0, Se 9,0-11,0, As 1,0-1,6, Sb 2,0-3,0, S 0,5 - 1,0. Оксидные стекла неорганические образуют SiO2, GeO2, В2О3, Р2О5, As2O3. Большая группа оксидов-ТеО2, TiO2r МоО3, WO3, Bi2O3, A12O3, Ga2O3, V2O5-образует стекла неорганические при сплавлении с др. модифицирующими оксидами, напр. CaO, Na2O и т.д. Оксидные стекла неорганические называют по виду стеклообразующего оксида: силикатные, боратные, фосфатные, германатные и т.д.
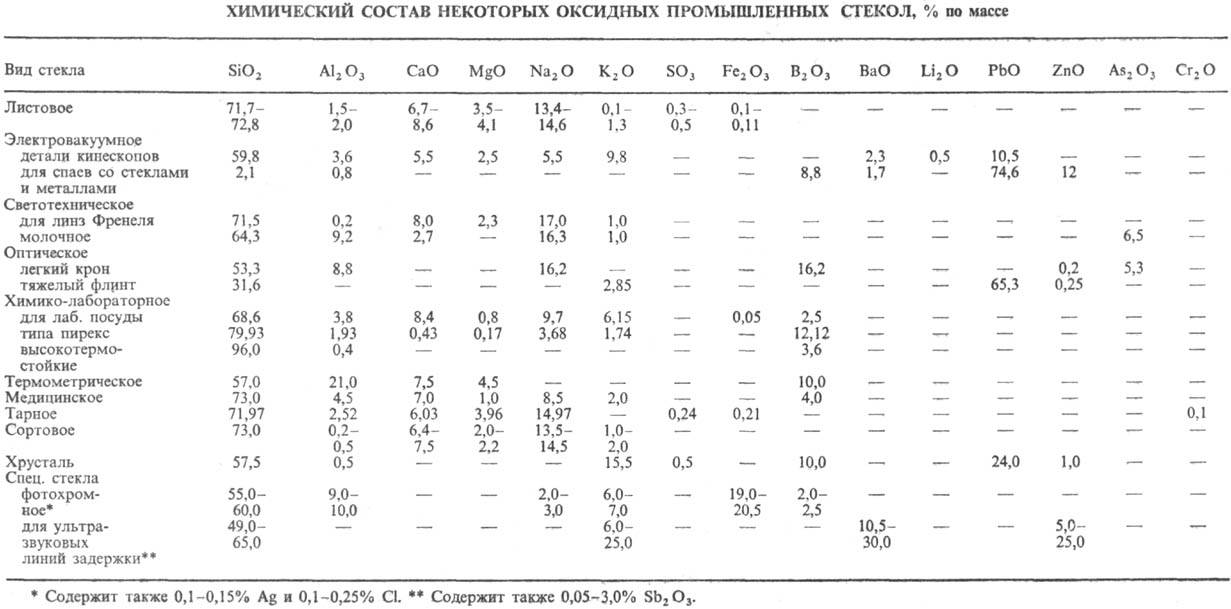
Из однокомпонентных стекол неорганических наиб. значение имеет силикатное стекло кварцевое, из бинарных-щелочносиликатные стекла неорганические состава M2O-SiO2 (М = Na, К), т. наз. стекло растворимое, из многокомпонентных - щелочносиликатные стекла неорганические, содержащие оксиды Ca, Mg, Al. Хим. состав нек-рых видов оксидных промышленных стекол неорганических приведен в таблице.
По назначению промышленные стекла неорганические разделяют на неск. видов: строительное (листовое-оконное, витринное, узорчатое, армированное; архитектурно-строительное - блоки, пакеты, профилированное стекло неорганическое, пеностекло; стеклянные.трубы); -техническое (оптич., хим.-лаб., мед., электротехн., све-тотехн., электроизоляц. и т.д.); стекловолокно; тарное; сортовое (для произ-ва стеклянной посуды); специальное (лазерное, фотохромное, оптически- и магнитоактивное, для ультразвуковых линий задержки и т.д.); стекло жидкое; эмали и покрытия; ситаллы.
Физико-химические свойства и применение. Оптические св-ва. Стекла неорганические отличаются прозрачностью в разл. областях спектра. Оксидные стекла неорганические характеризуются высокой прозрачностью в видимой области спектра: коэф. прозрачности т(т = I/I0, где I0 - интенсивность падающего на пов-сть стекла света, I-интенсивность света, прошедшего сквозь стекло) для оконного стекла неорганического 0,83-0,90, для оптического-0,95-0,99.
В связи с этим стекло неорганическое незаменимо при остеклении зданий и разл. видов транспорта, изготовлении зеркал и оптич. приборов, включая лазерные, лаб. посуды, ламп разл. ассортимента и назначения, осветит. аппаратуры, телевизионной техники, волоконно-оптич. линий связи, хим. аппаратуры.
В зависимости от состава и условий получения стекло неорганическое способно по-разному преломлять, рассеивать и поглощать свет в видимой, УФ, ИК и рентгеновской областях спектра (см. Оптические материалы), Нек-рым стеклам неорганическим свойственна также фоточувствительность, т. е. способность изменять коэф. поглощения под действием УФ или рентгеновского облучения, a-лучей, нейтронов, что используют в произ-ве т. наз. фотохромных стекол неорганических, а также при изготовлении аппаратуры и приборов для радиац. техники. Наиб. высоким светопропусканием в ИК области обладают алюмофосфатные и халькогенидные стекла неорганические, повышенным-стекла неорганические на основе SiO2; УФ лучи интенсивно поглощают стекла неорганические, содержащие оксиды Pb, Fe, Ti, рентгеновские и a-лучи-стекла неорганические с высоким содержанием оксидов Рb или Ва.
Галогенидные стекла неорганические на основе BeF2 отличаются уникальным комплексом оптич. постоянных, высокой устойчивостью к действию жестких излучений и агрессивных сред, таких, как F2, HF. Стекла неорганическое на основе фторидов Zr и Ва прозрачны в видимой и ИК областях спектра. Халькогенидные стекла неорганические обладают также электронной проводимостью; применяются в телевизионных высокочувствит. камерах, ЭВМ (в качестве переключателей или элементов запоминающих устройств).
Плотность промышленных стекол неорганических колеблется от 2,2 до 8,0 г/см3. Низкие значения плотности характерны для бо-ратных и боросиликатных стекол неорганических; среди силикатных стекол неорганических наим. плотностью обладает кварцевое. Введение в состав стекол неорганических щелочных и щел.-зем. оксидов приводит к увеличению его плотности: плотность возрастает при эквимолекулярной замене одного оксида другим в рядах Li2O < Na2O < К2О и MgO < CaO < SrO < ВаО < РbО. Плотность последних стекол неорганических достигает 8,0 г/см3.
Мех. св-ва. Стекло неорганическое-хрупкий материал, не обладает пластич. деформацией, весьма чувствителен к мех. воздействиям, особенно ударным. Значение модуля упругости различных стекол неорганических колеблется в пределах 44,2-87,2 ГПа. Наибольшее его значение характерно для малощелочных алюмосиликатных стекол неорганических с высоким содержанием оксидов Be, Mg и Ca, наименьшее-для боро- и свинцовосиликатных стекол неорганических с высоким содержанием оксидов В и Рb; модуль упругости кварцевого стекла неорганического 73,2 ГПа. Ударная вязкость силикатных стекол неорганических 1,5-2,0 кН/м, в то же время сопротивление сжатию такое же, как у чугуна,-0,5-2,5 ГПа.
Прочность стекла неорганического на изгиб 30-120 МПа. Техн. прочность определяется качеством пов-сти (наличие трещин Гриф-фитса).
Упрочняют стекло неорганическое обычно способами, способствующими созданию в нем поверхностных сжимающих напряжений (отжиг, термич. закалка, хим. упрочнение), причем прочность закаленного стекла неорганического в 4-6 раз превышает прочность отожженного. Хим. способы упрочнения-обработка пов-сти стекол неорганических газовыми реагентами (напр., SO3), ионный обмен (обработка пов-сти в расплавах солей щелочных металлов), поверхностная кристаллизация, нанесение полимерных и др. покрытий. Возможно также упрочнение травлением, т.е. путем удаления или "залечивания" дефектов при обработке пов-сти стекол неорганических разл. хим. реагентами. Так, напр., sизг для пром. листового стекла после действия фтористоводородной к-ты составляет 500-600 МПа.
При низкотемпературном (400-450°С) ионном обмене эффект упрочнения достигается вследствие замещения ионов одних щелочных металлов на, ионы др. щелочных металлов большего радиуса (напр., Li+ на Na+ или К+), в результате чего образуется сжатый поверхностный слой (порядка 20-40 мкм). При высокотемпературном (500-700°С) ионном обмене происходит замена катионов Na+ и К+ в стекле неорганическом на Li+, что снижает его коэф. температурного расширения; при этом в поверхностном слое при охлаждении образуются напряжения сжатия, что увеличивает прочность стекла неорганического в 2,0-2,5 раза, а его термостойкость в 1,5-2,0 раза.
При термич. обработке стекол неорганических при 700-1000°С упрочняющий эффект достигается вследствие поверхностной кристаллизации.
Электрич. св-ва стекол неорганических зависят от состава и т-ры среды-стекла неорганические могут быть диэлектриками, полупроводниками или проводниками. Большая группа оксидных стекол неорганических (силикатные, боратные, фосфатные) относится к классу изоляторов; почти идеальный изолятор - кварцевое стекло неорганическое. Поскольку носители тока в оксидных стеклах неорганических -катионы щелочных и щел.-зем. металлов, электропроводность, как правило, возрастает с увеличением их содержания в стеклах неорганических и повышением т-ры. Стеклянные изоляторы используют для высоковольтных линий электропередач. Пригодность электротехнических стекол неорганических для работы в тех или иных температурных условиях зависит от их состава и оценивается по т-ре (ТК100), при к-рой стекло неорганическое имеет уд. электрич. проводимость 1,00·10-6 См·м-1. Для кварцевого стекла ТК100600°С, для других, используемых в электротехн. пром-сти,-230-520°С.
Диэлектрич. проницаемость e обычных промышленных стеклах неорганических невелика, причем самое низкое значение у кварцевого стекла неорганического и стеклообразного В2О3 (3,8-4,0). С увеличением содержания в стеклах неорганических ионов щелочных и тяжелых металлов (Ва, Рb), обладающих высокой поляризуемостью, e повышается в силу влияния ионной поляризации. Возрастает она также с повышением т-ры выше 200 °С и при действии частот до 50 Гц. Диэлектрич. потери наиб. низки для силикатных стекол неорганических, для кварцевого стекла неорганического при 20°С и частоте 10-10 Гц tgd 0,0001. Для закаленных стекол неорганических tgd в 1,5-2,0 раза выше, чем для отожженных. Электрич. прочность стекол неорганических (пробивное напряжение) в однородном электрич. поле достигает высоких значений (104-105 кВ·м-1).
Термич. св-ва. Для обычных силикатных стекол термостойкость 60-100°С, для пирекса-280°С, для кварцевого стекла-ок. 1000°С. Для силикатных стекол неорганических коэф. теплопроводности 0,6-1,34 Вт/(м·°С), уд. теплоемкость при комнатной т-ре 0,3-1,05 кДж/(кг · К), коэф. линейного термич. расширения 5·10-7-120·10-7 К-1 (последнее значение-для свинецсодержащих стекол неорганических).
Хим. стойкость стекол неорганических характеризуется высокой стойкостью к действию влажной атмосферы, воды, к-т (HF, Н3РО4). Различают 4 гидролитич. класса хим. стойкости, оцениваемой по кол-ву щелочей и др. р-римых компонентов, перешедших в р-р при кипячении стекол неорганических в воде или р-рах к-т. Наиб. хим. стойкостью обладают кварцевое, боросиликатное (не более 17% В2О3) и алюмосиликатное стекла неорганические. Хим. стойкость стекол неорганических существенно возрастает также и при введении в состав оксидов Ti, Zr, Nb, Та, Sn. Стойкость стекол неорганических к реагентам с рН < 7 повышают путем спец. обработки или защиты пов-сти пленками кремнийорг. соединений, фторидами Mg, оксидами А1 и Zn. По убыванию интенсивности разрушающего действия на стекла неорганические хим: реагенты располагаются в след. ряд: HF > Н3РО4 > р-ры щелочей > р-ры щелочных карбонатов > НСl = H2SO4 > вода. Макс. потеря массы стекол неорганических на 100 см2 пов-сти в р-рах к-т (кроме HF, Н3РО4) составляет ок. 1,5 мг, в то время как в щелочных средах возрастает до 150 мг.
Получение стекла. Традиц. технология пром. способа получения стекол неорганических состоит в подготовке сырьевых материалов (дробление, сушка, просеивание), приготовлении шихты (дозирование сырьевых компонентов и их смешивание), варке, формовании изделий, отжиге, обработке (термич., хим., мех.).
В зависимости от назначения стекла неорганического сырье для его изготовления содержит разл. оксиды и минералы. Кремнезем, являющийся главной составной частью стекол неорганических, вводят в шихту в виде кварцевого песка или- молотого кварца (вредные примеси-соед. Сr и Fe, придающие стеклам неорганическим желтовато-зеленый и зеленый цвет). Для варки высококачеств. бесцветных стекол неорганических песок очищают физ. и хим. способами; размер зерен песка 0,2-0,5 мм. В2О3 в шихту вводят в виде буры или Н3ВО3, Р2О5-в виде фосфатов или Н3РО4, Аl2О3-в виде глинозема, каолина, глины, полевого шпата или Аl(ОН)3, Na2O-B виде Na2CO3, К2О-в виде К2СО3 или KNO3, СаО-в виде мела или известняка, ВаО-в виде ВаСО3, Ba(NO3)2 или BaSO4, MgO-в виде доломита или магнезита, Li2O-B виде Li2СО3 и прир. минералов лепидолита или сподумена, РbО-в виде сурика, глета или силиката Рb.
Вспомогат. материалы шихты - осветлители, обесцвечива-тели, красители, глушители, восстановители и др. В качестве осветлителей применяют небольшие кол-ва (NH4),SO4, Na2SO4, NaCl, As2O3 и As2O5 в сочетании с (NH4)2NO3, плавиковый шпат. Нек-рые из них одновременно являются и обесцвечивателями - окисляют в стеклах неорганических соед. Fe. Иногда для обесцвечивания в шихту вводят небольшие кол-ва в-в, окрашивающих стекломассу в дополнительный к зеленому
цвет (Se, соед. Со, Мh и др.). Окрашивают стекла неорганические, добавляя в шихту красящие в-ва. Желтую окраску стеклам неорганическим придают СrО3, NiO, Fe2O3, зеленую-Сr2О3 и СиО, синюю-СuО и СоО, фиолетовую - NiO и Мn2О3, розовую-СоО, МnО и Se, коричневую - Fe2O3, FeS, красно-рубиновую - коллоидные Си и Аи.
Процесс стекловарения -процесс получения однородного расплава - условно разделяют на неск. стадий: образование силикатов, стеклообразование, осветление, гомогенизация, охлаждение.
Варку стекол неорганических проводят в печах непрерывного действия разл. типа-электрич., газопламенных, газопламенных с дополнит. электроподогревом. На первой стадии вследствие плавления эвтектич. смесей и солей происходит образование силикатов и др. промежут. соединений, появляется жидкая фаза. Силикаты и непрореагировавшие компоненты вместе с жидкой фазой представляют собой на этой стадии плотную спекшуюся массу. Для большинства силикатных стекол неорганических первый этап завершается при 1100-1200 °С. На стадии стеклообразования при 1200-1250 °С растворяются остатки шихты, происходит взаимное растворение силикатов, удаляется пена и образуется относительно однородная стекломасса, насыщенная, однако, газовыми включениями, поскольку обычно шихта силикатных стекол неорганических содержит ок. 18% химически связанных газов (СО2, SO2, O2 и др.). На стадии осветления (1500-1600 °С, длительность-до неск. суток) происходит удаление из расплава газовых пузырей. Для ускорения процесса используют добавки, снижающие поверхностное натяжение массы. Одновременно с осветлением идет гомогенизация -усреднение расплава по составу. Наиб. интенсивно гомогенизация Осуществляется при мех. перемешивании стекломассы мешалками из огнеупорных материалов. На стадии охлаждения проводят подготовку стекломассы к формованию, для чего равномерно снижают т-ру на 400-500°С и достигают необходимой вязкости стекла неорганического. Формование изделий из стекломассы осуществляют разл. методами - прокатом, прессованием, прессвыдуванием, выдуванием, вытягиванием и др. на спец. стеклоформующих машинах.
Прессование применяют в произ-ве стеклянной тары, архитектурных деталей, посуды; выдувание-в произ-ве узкогорлой тары, сортовой (столовой) посуды, электровакуумных изделий; прессвыдувание-в машинном произ-ве ши-рокогорлой посуды; вытягивание-при изготовлении оконного и техн. листового стекол неорганических, трубок, труб, стержней, стеклянных волокон; прокатка-при произ-ве листового стекла неорганического разл. видов, преим. строительного толщиной 3 мм и более. Др. методы: отливка в формы при изготовлении крупногабаритных предметов, моллирование - получение изделий в форме при нагр. твердых кусочков стекол неорганических.
При произ-ве пеностекла в шихту (или тонкоизмельченный стеклянный бой) добавляют парообразователи, выделяющие при варке стекла газ и вспучивающие стеклянную массу. Вспенивают стекло при 700-800 °С (для обычной шихты) или 950-1150 °С (для шихты из глин, горных пород, нерудных ископаемых).
Помимо традиц. метода получения применяют новые-в частности золь-гель процесс, позволяющий при значительно более низких т-рах получать стекла неорганические высокой чистоты и однородности. Существуют три осн. варианта практич.. реализации этого метода. Суть первого-приготовление р-ров на основе особо чистых р-римых сырьевых материалов (солей и гидрооксидов металлов, металлоорг. соед.); переход от р-ра к золю, а затем гелю, высушивание геля с образованием аморфной порошкообразной шихты, ее плавление с образованием стекла.
Второй метод - поликонденсация (полимеризация) гелей, послед. их уплотнение при термич. обработке. Переход золь-гель-стекло включает след. стадии: растворение исходных алкоксидов металлов M(OR)n с образованием гомог. водных или орг. р-ров (М — Si, Аl, В, Ва, Ti и т. д.; R-CH3, C2H5, С3Н7, n-степень окисления металла), гидролиз алкоксидов и поликонденсация продуктов, приводящая к образованию золя, а затем твердого геля, по р-ции М(ОК)n + nН2О : М(ОН)„ + nROH, сушка геля при нагр., переход геля в стекло.
Третий метод заключается в гелировании золей, приготовленных из коллоидных дисперсий оксидов.
Описанным выше методом получают заготовки, трубы и волокна для оптич. световодов и др. элементов волоконной оптики.
Металлич., халькогенидные и галогенидные стекла неорганические получают быстрым охлаждением расплавов (см. Стеклообразное состояние). При этом часто используют сверхвысокие скорости охлаждения (105-108 К/с).
Историческая справка. Стеклоделие впервые возникло в Египте и Месопотамии в 4-м тыс. до н. э. В 1 в. н. э. наиб. крупный центр стеклоделия-Рим, с 9 до 17вв. н. э.-Венеция. В развитии стеклотехники условно выделяют 4 периода: в 4-2-м тыс. до н. э. из стекол неорганических делали украшения и предметы религиозного культа, во 2-1-м тыс. до н. э.-небольшие сосуды; 1-е тыс. до н. э. началось с изобретения стеклодувной трубки, что позволило стеклоделию достичь большой высоты, а стекла неорганические превратить в материал широкого потребления; нач. 19-кон. 20 вв. характеризуется распространением машинной техники, созданием многочисл. составов стекол неорганических и проникновением его во все области быта, науки и техники. В России стеклоделие развивалось с 10-11 вв. Основоположник научного стеклоделия в России-М. В. Ломоносов, организовавший первую научную лабораторию по переработке стекла. Первый стекольный завод в России построен в 1635.
Лит.: Роусон Г., Неорганические стеклообразующие системы, пер. с англ., М., 1970; Аппен А. А., Химия стекла, 2 изд., Л., 1974; Лазерные фосфатные стекла, М.,-1980; Борисова 3. У., Халькогенидные полупроводниковые стекла, Л., 1983; Химическая технология стекла и ситаллов, М., 1983; Фельц А., Аморфные и стеклообразные неорганические твердые тела, пер. с нем., М., 1986; Неорганические стекла и изделия на их основе для волоконно-оптических систем связи и датчиков, в сб.: Итоги науки и техники, сер. Технология силикатных и тугоплавких неметаллических материалов, т. 2, М., 1989; Physilische Chemie der Glasoherflache, Lpz., 1981; Shufflebotham P.K., "J. of non-crystalline solids", 1987, v. 92, № 2-3, p. 183-244; Rawson Н„ "IEE Proc.", 1988, pt A, v. 135, № 6, p. 325-45. П.Д. Саркисов, Л. А. Орлова.
