Молекула
Молекула (новолат. molecula, уменьшительное от лат. moles — масса), наименьшая частица вещества, обладающая его химическими свойствами. Молекула состоит из атомов, точнее — из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов, образующих химические связи (см. Валентность). Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул данного вещества не зависят от способа его получения. В случае одноатомных молекул (например, инертных газов) понятия молекулы и атома совпадают.
Впервые понятие о молекулах было введено в химии в связи с необходимостью отличать молекулу как наименьшее количество вещества, вступающее в химические реакции, от атома как наименьшего количества данного элемента, входящего в состав молекулы (Международный конгресс в Карлсруэ, 1860). Основные закономерности строения молекул были установлены в результате исследования химических реакций, анализа и синтеза химических соединений, а также благодаря применению ряда физических методов.
Атомы объединяются в молекулы в большинстве случаев химическими связями. Как правило, такая связь создаётся одной, двумя или тремя парами электронов, которыми владеют сообща два атома. Молекула может содержать положительно и отрицательно заряженные атомы, т. е. ионы; в этом случае реализуются электростатические взаимодействия. Помимо указанных, в молекулах существуют и более слабые взаимодействия между атомами. Между валентно не связанными атомами действуют силы отталкивания.
Состав молекул выражают формулами химическими. Эмпирическая формула (например, С2Н6О для этилового спирта) устанавливается на основании атомного соотношения содержащихся в веществе элементов, определяемого химическим анализом, и молекулярной массы.
Развитие учения о структуре молекул неразрывно связано с успехами прежде всего органической химии. Теория строения органических соединений, созданная в 60-х гг. 19 в. трудами А. М. Бутлерова, Ф. А. Кекуле, А. С. Купера и др., позволила представить строение молекул структурными формулами или формулами строения, выражающими последовательность валентных химических связей в молекулах. При одной и той же эмпирической формуле могут существовать молекулы разного строения, обладающие различными свойствами (явление изомерии). Таковы, например, этиловый спирт С5Н5ОН и диметиловый эфир (СН3)2О. Структурные формулы этих соединений разнятся:
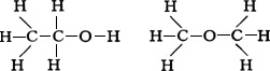
В некоторых случаях изомерные молекулы быстро превращаются одна в другую и между ними устанавливается динамическое равновесие (см. Таутомерия). В дальнейшем Я. Х. Вант-Гофф и независимо французский химик А. Ж. Ле Бель пришли к пониманию пространственного расположения атомов в молекуле и к объяснению явления стереоизомерии. А. Вернер (1893) распространил общие идеи теории строения на неорганические комплексные соединения. К началу 20 в. химия располагала подробной теорией строения молекул, исходящей из изучения только их химических свойств. Замечательно, что прямые физические методы исследования, развитые позднее, в подавляющем большинстве случаев полностью подтвердили структурные формулы химии, установленные путём исследования макроскопических количеств вещества, а не отдельных молекул.
В физике понятие о молекулах оказалось необходимым для объяснения свойств газов, жидкостей и твёрдых тел. Прямое экспериментальное доказательство существования молекул впервые было получено при изучении броуновского движения (французский физик Ж. Перрен, 1906).
В твёрдом теле молекулы могут сохранять или не сохранять свою индивидуальность. Так, большинство молекул органических соединений образует молекулярные кристаллы, в узлах решёток которых находятся молекулы, связанные одна с другой относительно слабыми силами межмолекулярного взаимодействия. Напротив, в ионных (например, в случае NaCI) и атомных (алмаз) кристаллах нет отдельных молекул и весь кристалл подобен одной молекуле (см. Кристаллохимия). Структура молекул может изменяться при переходе от кристалла к газу. Так, N2O5 в газе состоит из единых молекул, в кристалле — из ионов NO2+ и NO3- ; газообразный PCI5 — из молекул с конфигурацией тригональной бипирамиды, твёрдый — из октаэдрического иона PCl6- и тетраэдрического иона PCl4+.
Равновесные межъядерные расстояния r0 и энергии диссоциации D (при 25°С) некоторых двухатомных молекул
| Молекула | r0, Ǻ | D, кдж/моль (ккал/моль) | Молекула | r0, Ǻ | D,Кдж/моль (ккал/моль) |
| H2 | 0,74 | 426,5 (104,18) | Br2 | 2,14 | 192,7 (46) |
| Li2 | 2,67 | 104,7 (25) | I2 | 2,67 | 147,1 (35,1) |
| N2 | 1,09 | 94,3 (22,5) | LiH | 1,59 | 243 (58) |
| O2 | 1,21 | 495,7 (118,3) | NaH | 1,89 | 196,9 (47) |
| F2 | 1,48 | 155 (37) | HhF | 0,92 | 565,6 (135) |
| Na2 | 3,08 | 78,5 (17,3) | HCl | 1,27 | 431,6 (103) |
| Cl2 | 1,99 | 242,6 (57,9) | HI | 1,60 | 264 (63) |
Строение молекул. Геометрическая структура молекул определяется равновесным расположением атомных ядер. Энергия взаимодействия атомов зависит от расстояния между ядрами. На очень больших расстояниях эта энергия равна нулю; если при сближении атомов образуется химическая связь, то атомы сильно притягиваются друг к другу (слабое притяжение наблюдается и без образования химической связи); при дальнейшем сближении атомов действуют электростатические силы отталкивания атомных ядер; препятствием к сильному сближению атомов является также невозможность совмещения их внутренних электронных оболочек. На рис. 1 показана зависимость потенциальной энергии двухатомной молекулы от межъядерного расстояния r. Эта энергия минимальна при равновесном расстоянии r0, стремится к нулю при r ® ¥ и возрастает до ¥ при r ® 0. Разность энергий при r = r0 и r ® ¥ характеризует энергию связи, энергию диссоциации D. Равновесные расстояния r0 в двухатомных и многоатомных молекулах и, следовательно, расположение атомных ядер в молекулах определяются методами спектроскопии, рентгеновского структурного анализа и электронографии, а также нейтронографии, позволяющими получить сведения и о распределении электронов (электронной плотности) в молекулах. Рентгенографическое изучение молекулярных кристаллов даёт возможность установить геометрическое строение очень сложных молекул, вплоть до молекул белков. Косвенную, но весьма детальную информацию о строении сложных молекул получают различными спектроскопическими методами, в особенности с помощью спектров ядерного магнитного резонанса (ЯМР). Геометрия простых молекул, содержащих малое число атомов, также эффективно исследуется методами спектроскопии. Расстояния (в Ǻ) между 2 данными валентно связанными атомами приблизительно постоянны в молекулах различных соединений, они уменьшаются с увеличением кратности связи:
| C—C……………. | 1,54 | C—F…………….. | 1,39 |
| C=C……………... | 1,34 | C—Cl……………. | 1,77 |
| C- - -C (в бензоле)... | 1,39 | C—Br……………. | 1,92 |
| CºC……………... | 1,2 | C—I……………… | 2,1 |
| C—H…………….. | 1,09 | C—S…………….. | 1,82 |
| C—O…………….. | 1,42 | O—H……………. | 0,96 |
| C=O……………... | 1,21 | N—H…………….. | 1,01 |
| C—N…………….. | 1,46 | S—H…………….. | 1,35 |
Можно приписать каждому атому в данном валентном состоянии в молекуле определённый атомный, или ковалентный, радиус (в случае ионной связи — ионный радиус, см. Атомные радиусы, Ионные радиусы), характеризующий размеры электронной оболочки атома (иона), образующего химическую связь в молекуле. Представление о приблизительном постоянстве этих радиусов оказывается полезным при оценке межатомных расстояний и, следовательно, при расшифровке структуры молекул. Длина связи представляет собой сумму соответствующих атомных радиусов.
Размер молекулы как целого, т. с. размер её электронной оболочки, есть величина до некоторой степени условная — имеется отличная от нуля, хотя и весьма малая, вероятность найти электроны молекулы и на большом расстоянии от её атомных ядер. Практически размеры молекулы определяются равновесным расстоянием, на которое они могут быть сближены при плотной упаковке молекул в молекулярном кристалле и в жидкости. На больших расстояниях молекулы притягиваются одна к другой, на меньших — отталкиваются. Размеры молекул поэтому можно найти с помощью рентгеноструктурного анализа молекулярных кристаллов, порядок величины этих размеров может быть определён из коэффициентов диффузии, теплопроводности и вязкости газов и из плотности вещества в конденсированном состоянии. Расстояние, на которое могут сблизиться валентно не связанные атомы, принадлежащие одной и той же молекуле или различным молекулам, может быть охарактеризовано средними значениями т. н. ван-дер-ваальсовых радиусов (в Ǻ):
| H……... | 1,0-1,2 | S……… | 1,9 |
| C……... | 1,75-2,0 | Se…….. | 1,0 |
| N……... | 1,5 | Te…….. | 2,2 |
| P……… | 1,9 | F……… | 1,4 |
| As…….. | 2,0 | Cl……... | 1,8 |
| Sb…….. | 2,2 | Br……... | 2,0 |
| O……… | 1,4 | I………. | 2,2 |
Ван-дер-ваальсовы радиусы существенно превышают ковалентные. Зная величины ван-дер-ваальсовых, ковалентных, а также ионных радиусов, можно построить наглядные модели молекул, отражающие форму и размеры их электронных оболочек (рис. 2).
Ковалентные химические связи в молекулах расположены под определёнными углами, зависящими от состояния гибридизации атомных орбиталей (см. Валентность). Так, для молекул насыщенных органических соединений характерно тетраэдрическое расположение связей, образуемых атомом углерода; для молекул с двойной связью (С=С) — плоское расположение связей атомов углерода; в молекулах соединений с тройной связью (СºС) — линейное расположение связей:
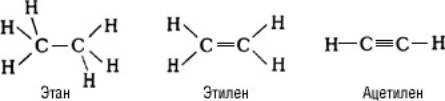
Таким образом, многоатомная молекула обладает определённой конфигурацией в пространстве, т. е. определённой геометрией расположения связей, которая не может быть изменена без их разрыва. Молекула характеризуется той или иной симметрией расположения атомов. Если молекула не имеет плоскости и центра симметрии, то она может существовать в двух конфигурациях, представляющих зеркальные отражения одна другой (зеркальные антиподы, или стереоизомеры, см. Изомерия). Все важнейшие биологически функциональные вещества в живой природе фигурируют в форме одного определённого стерсоизомера.
Молекулы, содержащие единичные связи, или сигма-связи, могут существовать в различных конформациях, возникающих при поворотах атомных групп вокруг единичных связей. Важные особенности макромолекул синтетических и биологических полимеров определяются именно их конформационными свойствами.
Взаимодействие атомов в молекуле. Природа химических связей в молекулах оставалась загадочной вплоть до создания квантовой механики — классическая физика не могла объяснить насыщаемость и направленность валентных связей. Основы теории химической связи были созданы В. Гейтлером и немецким учёным Ф. Лондоном в 1927 на примере простейшей молекулы Н2. В дальнейшем теория и методы расчёта были значительно усовершенствованы, в частности на основе широкого применения молекулярных орбиталей метода, и квантовая химия позволяет вычислять межатомные расстояния, энергии молекул, энергии химических связей и распределение электронной плотности для сложных молекул; при этом расчётные данные хорошо согласуются с экспериментальными.
Химические связи в молекулах подавляющего числа органических соединений являются ковалентными. Напротив, в ряде неорганических соединений существуют ионные, а также донорно-акцепторные связи (см. Химическая связь), реализуемые в результате обобществления неподелённой пары электронов данного атома. Энергия образования молекул из атомов во многих рядах сходных соединений приближённо аддитивна. Иными словами, в этих случаях можно считать, что энергия молекул есть сумма энергии её связей, имеющих постоянные значения в рассматриваемом ряду. Отсюда следует практическая возможность приписать химическим связям приближённо автономные электронные оболочки.
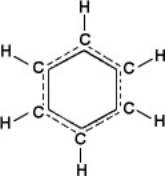
Аддитивность энергии молекул выполняется не всегда. Яркий пример нарушения аддитивности представляют плоские молекулы органических соединений с т. н. сопряжёнными связями, т. е. с кратными связями, чередующимися с единичными. В этих случаях валентные электроны, определяющие кратность связей, т. н. p-электроны, становятся общими для всей системы сопряжённых связей, делокализованными. Такая делокализация электронов приводит к дополнительной стабилизации молекул. Например, энергия образования молекулы 1,3-бутадиена Н2С=CH—CH=CH2 больше ожидаемой по аддитивности на 16,8 кдж/моль (на 4 ккал/моль). Выравнивание электронной плотности вследствие обобществления p-электронов по связям выражается в удлинении двойных связей и укорочении единичных. В правильном шестиугольнике межуглеродных связей и бензола (см. формулу) все связи одинаковы и имеют длину, промежуточную между длиной единичной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах (см. ниже).
Современная квантовомеханическая теория химической связи учитывает частичную делокализацию не только p-, но и s-электронов, наблюдающуюся в любых молекулах. Вообще говоря, это не нарушает аддитивности энергий молекул.
В подавляющем большинстве случаев суммарный спин валентных электронов в молекуле равен нулю, т. е. спины электронов попарно насыщены. Молекулы, содержащие неспаренные электроны — радикалы свободные (например, атомный водород Н··, метил CH··3), обычно неустойчивы, т. к. при их соединении друг с другом происходит значительное понижение энергии вследствие образования валентных связей. Наиболее эффективным методом изучения строения свободных радикалов является электронный парамагнитный резонанс (ЭПР).
Электрические и оптические свойства молекул. Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекулами — постоянным дипольным моментом и поляризуемостью. Дипольный момент означает несовпадение центров тяжести положительных и отрицательных зарядов в молекуле, т. е. электрическую асимметрию молекулы. Соответственно молекулы, имеющие центр симметрии, например H2, лишены постоянного дипольного момента; напротив, в HCl электроны смещены к атому Cl и дипольный момент равен 1,03 D (1,03×10-18 ед. СГС). Поляризуемостью характеризуется способность электронной оболочки любой молекулы смещаться под действием электрического поля, в результате чего в молекуле создаётся индуцированный дипольный момент. Значения дипольного момента и поляризуемости находят экспериментально с помощью измерений диэлектрической проницаемости. В случае аддитивности свойств молекулы дипольный момент молекулы может быть представлен суммой дипольных моментов связей (с учётом их направления), то же относится к поляризуемости молекулы.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны — тем самым они определяются поляризуемостью молекулы вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой — разделом физической оптики, посвященным изучению оптических свойств вещества.
Магнитные свойства молекул. Молекулы и макромолекулы подавляющего большинства химических соединений диамагнитны (см. Диамагнетизм). Магнитная восприимчивость молекул (c) в ряде органических соединений может быть выражена как сумма значений c для отдельных связей; однако аддитивность c выполняется хуже, чем аддитивность поляризуемостей a. И c, и a определяются свойствами внешних электронов молекулы; эти две величины связаны одна с другой.
Парамагнитны молекулы, обладающие постоянным магнитным моментом (см. Парамагнетизм). Таковы молекулы с нечётным числом электронов во внешней оболочке (например, NO и любые свободные радикалы), молекулы, содержащие атомы с незамкнутыми (незаполненными) внутренними оболочками (переходные металлы и др.). Магнитная восприимчивость парамагнитных веществ зависит от температуры, т. к. тепловое движение препятствует ориентации магнитных моментов в магнитном поле. Строение парамагнитных молекул эффективно изучается методом ЭПР.
Атомные ядра элементов, у которых атомный номер или массовое число нечётны, обладают ядерным спиновым парамагнетизмом. Для таких ядер характерен ядерный магнитный резонанс (ЯМР), спектр которого зависит от электронного окружения ядер в молекулах. Поэтому спектры ЯМР служат источником очень подробной информации о строении молекул, в том числе и весьма сложных, например белков (см. также Ядерный квадрупольный резонанс, Магнетизм, Магнетохимия).
Спектры и строение молекул. Электрические, оптические, магнитные и другие свойства молекул в конечном счёте связаны с волновыми функциями и энергиями различных состояний молекул; через них выражаются и электрический дипольный момент, и магнитный момент, и поляризуемость, и магнитная восприимчивость. Прямую информацию о состояниях молекул и вероятностях перехода между ними дают молекулярные спектры.
Частоты в спектрах, соответствующих вращательным переходам, зависят от моментов инерции молекул, определение которых из спектроскопических данных позволяет получить наиболее точные значения межатомных расстояний в молекулах.
Общее число линий или полос в колебательном спектре молекулы зависит от её симметрии. Частоты колебаний, наблюдаемые в спектрах, определяются, с одной стороны, массами атомов и их расположением, с другой — динамикой межатомных взаимодействий. Теория колебаний многоатомных молекул соответственно опирается на теорию химического строения и классическую механику связанных колебаний. Исследование колебательных спектров позволяет сделать ряд выводов о строении молекул, о межатомных и межмолекулярных взаимодействиях, изучать явления таутомерии, поворотной изомерии.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек, состояние химических связей. Спектры молекул, обладающих большим числом сопряжённых связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, построенные из таких молекул, обладают цветностью, к ним относятся все органические красители. Изучение электронно-колебательных спектров молекул необходимо для понимания естественной и магнитной оптической активности.
Молекулы в химии, физике и биологии. Понятие о молекулах — основное для химии, и большей частью сведений о строении и функциональности молекул наука обязана химическим исследованиям. При химической реакции происходит превращение одних молекул в другие. Для такого превращения обычно необходима некоторая избыточная энергия молекул — энергия активации (см. Кинетика химическая). В акте химического взаимодействия молекулы проходят через конфигурацию т. н. активированного комплекса, или переходного состояния молекул. Характер и скорость химической реакции определяются этим состоянием, в свою очередь зависящим от строения взаимодействующих молекул. Химия решает две главные задачи, относящиеся к молекулам, — устанавливает строение молекул на основании химических реакций и, наоборот, на основе строения молекул определяет ход реакций. Широкая совокупность важнейших проблем современной химии, в том числе и нерешённых, сводится к теории химической реакционной способности. Исследование этих проблем требует применения как теоретических методов квантовой химии, так и экспериментальных данных, получаемых химическими и физическими методами.
Физические явления, определяемые строением и свойствами молекул, изучаются молекулярной физикой. Термодинамические свойства любого вещества, построенного из молекул, в конечном счёте выражаются через значения энергий всех возможных состояний молекул, находимых из спектроскопических данных. Строение молекул и межмолекулярные взаимодействия ответственны за равновесные свойства вещества. То же относится к неравновесным, кинетическим, свойствам. Установление равновесия требует некоторого времени — времени релаксации. При быстрых изменениях состояния вещества равновесие может не успеть установиться. Эти явления наблюдаются, например, при прохождении ультразвука через вещество и сказываются на поглощении и дисперсии звуковых волн (см. Молекулярная акустика). Равновесие устанавливается в результате взаимодействия молекул при их соударениях в газе и жидкости, в результате поглощения и излучения света и т. д. Время релаксации молекул в конденсированной среде существенно зависит от температуры, с ростом которой увеличивается подвижность молекул. В ряде случаев молекулы в жидкости практически утрачивают свою подвижность ещё до кристаллизации: происходит стеклование вещества. Подвижностью молекул определяются способность веществ к диффузии, их вязкость, теплопроводность и т. д. Непосредственное изучение подвижности молекул, определение времён релаксации проводятся методами поглощения и дисперсии электромагнитных волн, ЯМР, ЭПР и другими способами.
Равновесные и кинетические свойства больших цепных молекул, образующих полимеры (см. Макромолекула), специфичны. Особенности поведения макромолекул определяются прежде всего их гибкостью — способностью находиться в большом числе различных конформаций, возникающих в результате поворотов вокруг единичных связей.
Развитие биологии, химии и молекулярной физики привело к построению молекулярной биологии, исследующей основные явления жизни, исходя из строения и свойств биологически функциональных молекул. Организм существует на основе тонко сбалансированных химических и нехимических взаимодействий между молекулами. Таким образом, изучение строения и свойств молекул имеет фундаментальное значение для естествознания в целом.
Лит.: Сыркин Я. К., Дяткина М. Е., Химическая связь и строение молекул, М. — Л., 1946; Паулинг Л., Природа химической связи, пер. с англ., М. — Л., 1947; Волькенштейн М В., Строение и физические свойства молекул, М. — Л., 1955; его же, Молекулы и жизнь, М., 1965; его же, Перекрёстки науки, М., 1972; Кондратьев В. Н., Структура атомов и молекул, 2 изд., М., 1959; Козман У., Введение в квантовую химию, пер. с англ., М., 1960; Слэтер Дж., Электронная структура молекул, пер. с англ., М., 1965.
М. В. Волькенштейн.
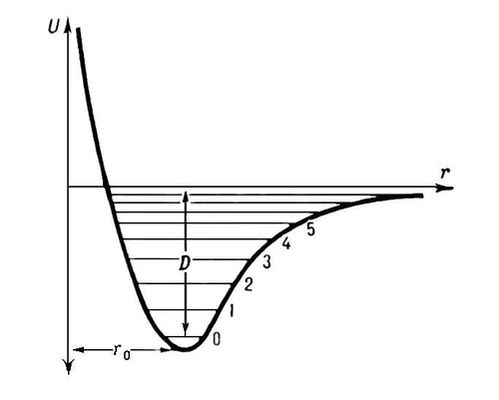
Рис. 1. Зависимость потенциальной энергии U двухатомной молекулы (или отдельной химической связи) от межатомного расстояния r (r0 — равновесное расстояние, D — энергия диссоциации, 0, 1, 2, ... — уровни энергии колебаний).
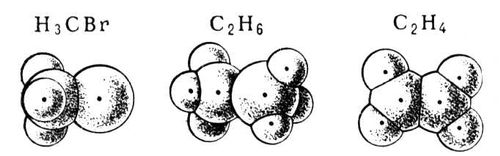
Рис. 2. Модели структур некоторых простых молекул (радиусы сфер — ван-дер-ваальсовы).
