Родий
РОДИЙ (от греч. rhodon-роза, по розовато-красному цвету его солей; лат. Rhodium) Rh, хим. элемент VIII гр. периодич. системы, ат. н. 45, ат. м. 102,9055, относится к платиновым металлам. В природе один стабильный изотоп 103Rh. Поперечное сечение захвата тепловых нейтронов 1,56·10-26 м2. Конфигурация внеш. электронных оболочек атома 4d85s1; степени окисления 0, +1, +2, +3 (наиб. устойчива), +4, + 5, + 6; энергии ионизации Rh0 : Rh+ : Rh2+ : Rh3+ соотв. 7,46, 18,077 и 31,04 эВ; электроотрицательность по Полингу 2,28; сродство к электрону 1,68 эВ; атомный радиус 0,1342 нм, ионный радиус (координац. число 6) Rh3+ 0,081 нм, Rh4+ 0,074 нм, Rh5+ 0,069 нм.
Содержание родия в земной коре 1·10-7% по массе. Родий образует твердые р-ры с др. платиновыми металлами, входит в состав самородной Pt и минералов группы осмистого Ir. В виде примеси встречается в сернистых, мышьяковистых и сурьмянистых соед. платиновых металлов, сопутствующих медно-никелевым сульфидным рудам. Содержание родия в прир. сырье колеблется от 0,2% (никелевые минералы) до 11,3% (родистый невьянскит).
Свойства. Родий-серебристо-белый металл, кристаллизуется в гранецентрир. кубич. решетке типа Сu, а = 0,3803 нм, z = 4, пространств. группа Fm3m; т. пл. 1963 °С, т. кип. 3727 °С; плотн. 12,41 г/см3 (20 °С); 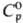 24,95 Дж/(моль · К); DHпл 21,53 кДж/моль,
24,95 Дж/(моль · К); DHпл 21,53 кДж/моль, 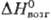 555,9 кДж/моль, DHисп 495,3 кДж/моль;
555,9 кДж/моль, DHисп 495,3 кДж/моль; 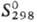 31,48 ДжДмоль·К); температурный коэф. линейного расширения 8,3·10-6 К-1 (293-373 К); r 4,1 мкОм·см (0°С), 4,33 мкОм·см (20 °С), температурный коэф. r 4,6 · 10-3 К-1 (0-100°С); теплопроводность 150,6 Вт/(м · К); парамагнитен, уд. магн, восприимчивость + 0,99·10-6; модуль упругости 320 ГПа; для отожженного образца sраст 700 МПа, твердость по Виккерсу 100-120. Отражат. способность пов-сти родия 80% для видимой части спектра.
31,48 ДжДмоль·К); температурный коэф. линейного расширения 8,3·10-6 К-1 (293-373 К); r 4,1 мкОм·см (0°С), 4,33 мкОм·см (20 °С), температурный коэф. r 4,6 · 10-3 К-1 (0-100°С); теплопроводность 150,6 Вт/(м · К); парамагнитен, уд. магн, восприимчивость + 0,99·10-6; модуль упругости 320 ГПа; для отожженного образца sраст 700 МПа, твердость по Виккерсу 100-120. Отражат. способность пов-сти родия 80% для видимой части спектра.
Стандартные электродные потенциалы: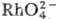 /Rh3+ 1,5 В, RhO2+/Rh3+ 1,4В, Rh3+/Rh0 0,7В, [RhCl6]2-/[RhCl6]3-1,2 В, [RhCl6]3-/Rh0 0,5 В, [Rh(C14)6]3-/[Rh(CN)6]4-— 0,9 В. Компактный металл при обычных условиях ни с чем не реагирует. Измельченный родий медленно окисляется на воздухе при 600 °С, наиб. скорость окисления при 800 °С, при этом образуется Rh2O3. При 100 °С H2SO4, p-p NaCIO или НВг очень медленно взаимод. с родием. Расплавл. цианиды (KCN: NaCN = 1:2) при 550 °С реагируют с родием энергичнее, чем с др. платиновыми металлами. Родий переходит в р-р после сплавления с KHSO4, Na2O2 или спекания с ВаО2. Мелкодисперсный родий, полученный после растворения его сплава с Zn или Cd, способен взрывать на воздухе. Родий раств. в расплавл. свинце.
/Rh3+ 1,5 В, RhO2+/Rh3+ 1,4В, Rh3+/Rh0 0,7В, [RhCl6]2-/[RhCl6]3-1,2 В, [RhCl6]3-/Rh0 0,5 В, [Rh(C14)6]3-/[Rh(CN)6]4-— 0,9 В. Компактный металл при обычных условиях ни с чем не реагирует. Измельченный родий медленно окисляется на воздухе при 600 °С, наиб. скорость окисления при 800 °С, при этом образуется Rh2O3. При 100 °С H2SO4, p-p NaCIO или НВг очень медленно взаимод. с родием. Расплавл. цианиды (KCN: NaCN = 1:2) при 550 °С реагируют с родием энергичнее, чем с др. платиновыми металлами. Родий переходит в р-р после сплавления с KHSO4, Na2O2 или спекания с ВаО2. Мелкодисперсный родий, полученный после растворения его сплава с Zn или Cd, способен взрывать на воздухе. Родий раств. в расплавл. свинце.
Сесквиоксид Rh2O3-серые кристаллы гексагон. синго-нии; при 750 °С переходит в др. модификацию; разлагается выше 1000 °С на металл и О2; плотн. 8,20 г/см3,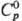 103,7 Дж/(моль · К);
103,7 Дж/(моль · К); 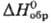 - 355 кДж/моль,
- 355 кДж/моль,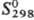 106,2 Дж/(моль·К); не раств. в воде, к-тах; получают при нагр. на воздухе измельченного родия, его нитрата или хлорида. Гидроксид Rh(OH)3, или Rh2O3·5H2O,-лимoннo-жeлтый; разлагается ок. 200 °С; не раств. в воде, гигроскопичен; получают взаимод. солей Rh(III) со щелочами.
106,2 Дж/(моль·К); не раств. в воде, к-тах; получают при нагр. на воздухе измельченного родия, его нитрата или хлорида. Гидроксид Rh(OH)3, или Rh2O3·5H2O,-лимoннo-жeлтый; разлагается ок. 200 °С; не раств. в воде, гигроскопичен; получают взаимод. солей Rh(III) со щелочами.
Фториды родия образуются при фторировании родия при 500-600°С. Гексафторид RhF6: т. пл. 70°С, т. кип. 73,5 °С; DHисп 41,8 кДж/моль; неустойчив. Пентафторид RhF5-темно-красные кристаллы; т. пл. 95,5°С. Трифторид RhF3-красные кристаллы; возгоняется выше 600 °С; плотн. 5,38 г/см3; не раств. в воде, к-тах и р-рах щелочей. Три-хлорид RhCl3-красные кристаллы моноклинной сингонии; т. возг. ок. 800 °С, т. разл. 970 °С; не раств. в воде и к-тах; в солянокислых р-рах существует в виде [RhCl6]3- или его аквазамещенных; образуется при хлорировании родия при 250-300 °С, тригидрат (полиядерное соед. переменного состава)-растворением Rh(OH)3 в соляной к-те. Сульфиды: Rh2S3 (черные кристаллы ромбич. сингонии, плотн. 6,40 г/см3 , 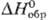 - 242 кДж/моль); Rh2S5 и Rh3S4 (кристаллы,
- 242 кДж/моль); Rh2S5 и Rh3S4 (кристаллы,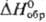 - 318 кДж/моль); Rh9S8 (
- 318 кДж/моль); Rh9S8 (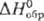 - 640 кДж/моль). Известны и др. соед. Rh, напр. Rh2P, RhSb, сульфат.
- 640 кДж/моль). Известны и др. соед. Rh, напр. Rh2P, RhSb, сульфат.
Комплексы Rh(III) имеют октаэдрич. конфигурацию, диамагнитны, кинетически инертны в р-циях замещения.
Аквакомплекс [Rh(H2O)6]3+ существует в кислых водных р-рах и кристаллич. состоянии в виде [Rh(H2O)6](ClO)3; рКа1 3,40. Его кислотные св-ва падают при замещении,воды на др. лиганды, напр. при замещении 5 молекул Н2О на NH3 рКа 6,80. Комплексы Rh(III) получают из Na3[RhClj (образуется по р-ции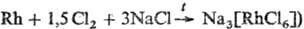 либо из его водных р-ров, содержащих [RhCl6-x(H2O)x]3-x. Получены [RhX6-xYx], где X = Hal-, Y = Н2О, NH3, амины,
либо из его водных р-ров, содержащих [RhCl6-x(H2O)x]3-x. Получены [RhX6-xYx], где X = Hal-, Y = Н2О, NH3, амины, , SCN- , N-3,
, SCN- , N-3,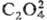 и др. Наиб. легко выделяются соед., содержащие [RhX3Y3], [RhXY5], [RHX5Y] и [RhX6]. Конц. р-ры галогенидов родия содержат полиядерные частицы, в к-рых фрагменты связаны галогенидными мостиками по ребру октаэдра
и др. Наиб. легко выделяются соед., содержащие [RhX3Y3], [RhXY5], [RHX5Y] и [RhX6]. Конц. р-ры галогенидов родия содержат полиядерные частицы, в к-рых фрагменты связаны галогенидными мостиками по ребру октаэдра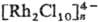 , для димеров иногда по грани. В комплексах Rh(III) проявляется статич. и динамич. трансвлияние лигандов.
, для димеров иногда по грани. В комплексах Rh(III) проявляется статич. и динамич. трансвлияние лигандов.
Комплексы Rh(I) имеют конфигурацию квадрата, диамагнитны, кинетически лабильны в р-циях замещения, устойчивы в твердом состояния и неводных р-рах в отсутствие окислителей. Их получают из карбонилхлорида Rh(I) (оранжево-желтые кристаллы тетрагон. сингонии, т. пл. 123 °С), напр.:
[Rh(CO)2Cl], + 2L : 2[Rh(CO)2LCl] [Rh(CO)2Cl]2 + 2диен : [Rh(диен)Сl]2 + 2СО
Получены комплексы, где L-фосфины, арсины, стибины, СО и галогены, алкены, алкины, арены и др. Комплексы Rh(I) присоединяют малые молекулы (Н2, О2, СО2, НС1), давая комплексы Rh(III) (окислит. присоединение), могут катализировать р-ции гомогенного гидрирования и гидро-формилирования орг. соединений. Известны соед. Rh(I) со связями металл-металл-[N(C2H5)4]4[Rh2X2(SnCl3)4], где X = Hal-, фосфины, арсины, стибины, арены. См. также Родийорганические соединения.
Соед. Rh(0)-гoмoядepныe и гетероядерные кластеры; диамагнитны, устойчивы в твердом состоянии и неводных р-рах в отсутствие окислителей. Карбонилы получают из безводного RhCl3 и СО при давлении до 20 МПа: при 50-80 °С образуется тетраэдрич. Rh4(CO)12 (красный, т. разл. 150°С), при 80-220 °С-октаэдрич. Rh6(CO)16 (черный, т. разл. 220 °С). Для кластеров родия характерны след. р-ции: пиролиз с уменьшением нуклеарности кластерного остова; замещение одного или неск. атомов каркаса на др. металл; замещение лигандов; конденсация фрагментов кластеров с увеличением нуклеарности; выключение гетероатома в центр кластерного остова; восстановление кластера с образованием анионов. Получены кластерные соединения родия: [Rh4(СО)12-x{Р(ОРh)3}x где x=1-4, [Fe2Rh(CO)x] и др.
Мономерные комплексы Rh(II) неустойчивы, парамагнитны. Известны [RhL2Cl]+, [RhL3]2+, [RhL2(H2O)2]2+, где L-2,2'-дипиридил. Устойчивые соед. Rh(II) димерны, диамагнитны; получают восстановлением [RhCl6]3- в водно-спиртовых р-рах в присут. карбоновых к-т. Напр., [Rh2(RCO2)4] имеет структуру "фонарика" с четырьмя мостиковыми лигандами и связью Rh—Rh; образует аддук-ты [Rh2(RCO2)4X2], где X = Н2О, пиридин и др.
Соединения родия в степенях окисления выше + 3 неустойчивы; получены K2[RhF6] (желтый), Cs2[RhCl6] (зеленый), Cs[RhF6] (темно-красный).
Получение. Родий концентрируется в маточных р-рах после выделения Pt и Pd из солянокислых р-ров, полученных при переработке сырой Pt или шламов электрохим. рафинирования Си и Ni. Для отделения неблагородных металлов используют нитрование, при этом хлоридные комплексы родия переходят в р-римое соед. Na3[Rh(NO2)6], к-рое осаждают NH4C1 в виде (NH4)2Na[Rh(NO2)6]. Его переводят в р-р нагреванием с соляной к-той и,восстанавливают муравьиной к-той до родиевой черни. При нагр. ее в атмосфере Н2 до 1000°С получают родиевую губку.
Аффинаж родия состоит в переводе сырой родиевой губки в р-р путем хлорирования, превращении образовавшихся хлоридных комплексов в одно го след. соед.: [Rh(NH3)5Сl]Сl2, [Rh(NH3)3Cl3], (NH4)3[Rh(SO3)3], (NH4)3[RhCl6] с послед. прокаливанием до родиевой губки. Существуют варианты аффинажа с использованием экстракционных и ионообменных методов. Чистую родиевую губку переплавляют путем индукц. нагрева в инертной атмосфере.
Применение. Осн. области применения родия-произ-во сплавов на основе Pt с содержанием родия 7, 10, 30% (и более) для стеклоплавильных аппаратов; изготовление тиглей в произ-ве оптич. стекла и монокристаллов; нанесение защитных покрытий на электрич. контакты; нанесение зеркальных покрытий в произ-ве рефлекторов, прожекторов, техн. зеркал, прецизионных измерит. приборов; получение сплавов с Pt и др. платиновыми металлами-катализаторов в произ-ве HNO3, а также для дожигания выхлопных газов автомобилей; изготовление термопар для измерения т-р до 1570 К (Pt-Rh), до 2570 К (Ir-Rh); изготовление катализаторов р-ции гидроформилирования, гидрирования олефинов и ацетиленов и др.; ювелирное дело (ограниченно).
Родий открыл У. Волластон в 1804.
Лит.: Сплавы благородных металлов для новой техники, Свердловск, 1983; Мoelwyn-Hughes J. Т., "J. of the South African Chem. Institute", 1972, v. 25, № 3, p. 155-65; Cole-Hamilton D.J., "Coordination Chem. Reviews", 1981, v. 35, p. 113-.42; Levason W., "Ana Repts Progr. Chem.", 1933, sec. A, v. 80, p. 245-75.
А. В. Беляев.
