Хроморганические соединения
ХРОМОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат связь Сr — С. По типу орг. лиганда и характеру его связи с металлом хроморганические соединения можно разделить на соед. с s-связью Сr — С, изонитрильные, карбеновые и карбиновые комплексы, а также p-комплексы. Из последних наиб. интересны соед. с 5-, 6- и 7-членными лигандами. Известны также немногочисленные би- и полиядерные комплексы с ареновыми и циклопентадиенильными лигандами. Хром в хроморганических соединениях может находиться в степенях окисления 0, +1, +2, +3, +4.
Большинство хроморганических соединений синтезируют на основе гексакарбонила хрома [Сr(СО)6] и карбонильных комплексов с лигандами n-иp-типа.
Хроморганические соединения с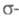 связью в большинстве своем являются гетеролигандными. Немногочисленные гомолигандные R3Cr, R4Cr неустойчивы. Известны анионные комплексы, напр. M3[CrR6], M[CrR3], K3[Cr(CO)3(C2R)3] (M - щелочной металл, R - алкенил, арил). Наиб. важны производные Сг(Ш) типа [CrR3L3,] (где L, напр., ТГФ).
связью в большинстве своем являются гетеролигандными. Немногочисленные гомолигандные R3Cr, R4Cr неустойчивы. Известны анионные комплексы, напр. M3[CrR6], M[CrR3], K3[Cr(CO)3(C2R)3] (M - щелочной металл, R - алкенил, арил). Наиб. важны производные Сг(Ш) типа [CrR3L3,] (где L, напр., ТГФ).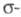 Арильные комплексы Сr(III) в отсутствие стабилизирующих лигандов претерпевают гомолиз связи Сr — С и
Арильные комплексы Сr(III) в отсутствие стабилизирующих лигандов претерпевают гомолиз связи Сr — С и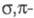 перегруппировку с образованием бисареновых
перегруппировку с образованием бисареновых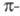 комплексов Сг(0). Синтезируют [CrR3(TГФ)3] взаимод. СrС13 с RMgX в р-ре ТГФ; при использовании RM (М -щелочные металлы) образуются анионные комплексы.
комплексов Сг(0). Синтезируют [CrR3(TГФ)3] взаимод. СrС13 с RMgX в р-ре ТГФ; при использовании RM (М -щелочные металлы) образуются анионные комплексы.
Изонитрильные комплексы Сr м. б. гомолигандными [Cr(CNR)6] и гетеролигандными, напр. [Cr(CO)n(CNR)6-n], [Cr(CO)2(CNR)(apeн)]. Получают их замещением СО в кар-бонилах Сг, из соед. [Cr(bipy)3] (bipy - бипиридил) и [Сr( -С10Н8)2] путем обмена лигандов, восстановлением соед. Сr высшей степени окисления в присут. избытка изонитрила.
-С10Н8)2] путем обмена лигандов, восстановлением соед. Сr высшей степени окисления в присут. избытка изонитрила.
Осн. типы карбеновых комплексов - [Сr(СО)5{ = = C(R)(X)}], [Cr(CO)2(C6H6){=C(R)(X)}], гдe X = OR', SR', NR'R"; комплексы типа [Cr(CO)5(=CRR')], не содержащие гетероатома, встречаются редко.
Для карбеновых комплексов характерны р-ции нуклеоф. замещения у карбенового атома С, а также р-ции присоединения карбена к активир. олефинам или ацетиленам, напр.:
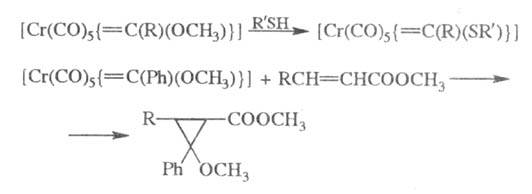
Получают карбеновые комплексы взаимод. карбонилов Сr с RLi, напр.:
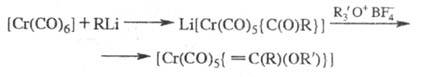
Осн. типы карбиновых комплексов - нейтр. [Сr(СО)4( CR)X] и катионные [Сr(СО)5(
CR)X] и катионные [Сr(СО)5(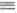 CR)]X. При взаимод. с нуклеофилами они образуют карбеновые комплексы, напр.:
CR)]X. При взаимод. с нуклеофилами они образуют карбеновые комплексы, напр.:
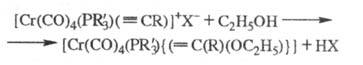
Карбиновые комплексы Сr синтезируют из карбеновых комплексов, напр.:
Олефиновые комплексы Сr, как правило, гетеролигандны. Хром легко образует комплексы с циклич. полиолефинами: норборнадиеном, циклогептатриеном, циклооктадиеном и циклооктатетраеном. Получают их замещением карбонильного лиганда либо соконденсацией паров Сr и олефина в высоком вакууме.
комплексы Сr, как правило, гетеролигандны. Хром легко образует комплексы с циклич. полиолефинами: норборнадиеном, циклогептатриеном, циклооктадиеном и циклооктатетраеном. Получают их замещением карбонильного лиганда либо соконденсацией паров Сr и олефина в высоком вакууме.
Ацетиленовые комплексы Сr немногочисленны. Осн. типы - [Cr(CO)(NO)(C2H2)(
комплексы Сr немногочисленны. Осн. типы - [Cr(CO)(NO)(C2H2)(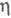 -C5H5)], [Cr(CO)2(C2R2)(C6H6)]. Их получают р-циями обмена лигандов, восстановлением солей Сr в присут. ацетилена.
-C5H5)], [Cr(CO)2(C2R2)(C6H6)]. Их получают р-циями обмена лигандов, восстановлением солей Сr в присут. ацетилена.
Из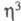 -аллильных комплексов Сr наиб. распространены [Сr(
-аллильных комплексов Сr наиб. распространены [Сr(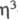 -аллил)3]. При термолизе и УФ облучении они превращаются в [Сr2(
-аллил)3]. При термолизе и УФ облучении они превращаются в [Сr2(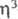 -аллил)4], с СО дают [Сr(СО)(
-аллил)4], с СО дают [Сr(СО)(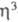 -аллил)2]или [Сr(СО)6], с HХ и I2 - [Сr(
-аллил)2]или [Сr(СО)6], с HХ и I2 - [Сr(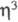 -аллил)2Х]2. Получают [Сr(
-аллил)2Х]2. Получают [Сr(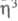 -аллил)3] из аллилмагнийхлорида и СrС13.
-аллил)3] из аллилмагнийхлорида и СrС13.
Из циклопентадиенильных комплексов Сr наиб. изучены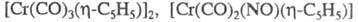 и
и Известны также
Известны также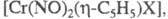
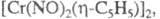
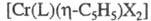 и
и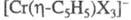 (X - галоген, L - Ph3P и др.). Димер
(X - галоген, L - Ph3P и др.). Димер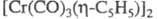 - диамагнитен, в мягких условиях претерпевает обратимый гомолиз связи Сr — Сr и образует парамагн. мономер
- диамагнитен, в мягких условиях претерпевает обратимый гомолиз связи Сr — Сr и образует парамагн. мономер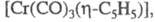 при нагр. в толуоле димер декарбонилируется до [Сr2(СО)4(
при нагр. в толуоле димер декарбонилируется до [Сr2(СО)4( -С5Н5)2], с Но дает [Сr(СО)3(
-С5Н5)2], с Но дает [Сr(СО)3( -С5Н5)], с амальгамой Na - Na[Cr(CO)3(
-С5Н5)], с амальгамой Na - Na[Cr(CO)3( -C5H5)] (последний с RX дает [Cr(R)(CO)3(
-C5H5)] (последний с RX дает [Cr(R)(CO)3( -C5H5)]).
-C5H5)]).
Получают [Сr(СО)3(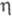 -С5Н5)]2 из [Сr(СО)6] и дициклопентадиена или циклопентадиенида Na либо из СО и хромоцена; [Cr(CO)2(NO)(
-С5Н5)]2 из [Сr(СО)6] и дициклопентадиена или циклопентадиенида Na либо из СО и хромоцена; [Cr(CO)2(NO)( -C5H5)] из [Сr(СО)3(
-C5H5)] из [Сr(СО)3(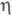 -С5Н5)]- и NOC1 или фотолизом [Сr(СО)n(
-С5Н5)]- и NOC1 или фотолизом [Сr(СО)n(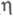 -С5Н5)]2(п = 2, 3) в присуг. NO.
-С5Н5)]2(п = 2, 3) в присуг. NO.
При взаимод. галогенидов Сr(II) или Сr(III) с циклопентадиенидом Na либо Сr(СО)6 с циклопентадиеном образуется парамагн. хромоцен [Сr(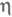 -С5Н5)2] (расстояние Сr — С 0,217 нм; оно больше, чем соответствующее расстояние Fe — С в ферроцене); он обратимо окисляется до катиона [Сr(
-С5Н5)2] (расстояние Сr — С 0,217 нм; оно больше, чем соответствующее расстояние Fe — С в ферроцене); он обратимо окисляется до катиона [Сr(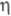 -С5Н5)2]+ (потенциал полуволны окисления -0,67 В относительно насыщ. каломельного электрода) и обратимо восстанавливается до аниона [Сr(
-С5Н5)2]+ (потенциал полуволны окисления -0,67 В относительно насыщ. каломельного электрода) и обратимо восстанавливается до аниона [Сr(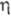 -С5Н5)2]- (при -2,3 В); с FеС12 дает ферроцен, с СО, НХ, СС13, S и др.- продукты замещения одного С5Н5-лиганда.
-С5Н5)2]- (при -2,3 В); с FеС12 дает ферроцен, с СО, НХ, СС13, S и др.- продукты замещения одного С5Н5-лиганда.
Хром образует комплексы с ароматич. соед. Наиб. изучены [Сr(СО)3(арен)]. Для них характерны р-ции обмена лигандов: при УФ облучении замещается одна группа СО на RNH2, RNC, RCN, олефин, ацетилен; при взаимод. с аминами, фосфинами и др. замещается ареновый лиганд и образуются комплексы типа [Сr(СО)3L3] (L = NH3, C5H5N, PR3, P(OR)3]; би- и тридентантные лиганды при 160-220 °С образуют продукты замещения и аренового и карбонильных лигандов, напр. [Cr(bipy)3]. Р-ции электроф. замещения атома Н (меркурирование, ацилирование, дейтерирование в кислой среде) в аренкарбонильных комплексах Сr затруднены по сравнению с аналогичными р-циями бензола; напротив, р-ции с бутиллитием и дейтерирование в основной среде протекают в более мягких условиях.
комплексы с ароматич. соед. Наиб. изучены [Сr(СО)3(арен)]. Для них характерны р-ции обмена лигандов: при УФ облучении замещается одна группа СО на RNH2, RNC, RCN, олефин, ацетилен; при взаимод. с аминами, фосфинами и др. замещается ареновый лиганд и образуются комплексы типа [Сr(СО)3L3] (L = NH3, C5H5N, PR3, P(OR)3]; би- и тридентантные лиганды при 160-220 °С образуют продукты замещения и аренового и карбонильных лигандов, напр. [Cr(bipy)3]. Р-ции электроф. замещения атома Н (меркурирование, ацилирование, дейтерирование в кислой среде) в аренкарбонильных комплексах Сr затруднены по сравнению с аналогичными р-циями бензола; напротив, р-ции с бутиллитием и дейтерирование в основной среде протекают в более мягких условиях.
Галогенсодержащие ареновые комплексы [Сr(СО)3(С6Н5Х)] (X = Cl, F) легко замещают галоген на RO-, CN-, карбанионы. Эти р-ции широко применяют в орг. синтезе. Получают аренкарбонильные комплексы обменом лигандов при нагревании аренов с [Cr(CO)6], [Cr(CO)3L3] либо [Сr(СО)3(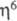 -С10Н8)].
-С10Н8)].
Бисареновые комплексы [Сr(арен)2] - термически устойчивые в-ва (до 200-300 °С в отсутствие О2); дибензолхром имеет сэндвичевую структуру с заслоненной конформацией. Хим. (окислители - О2 + Н2О, I2, алкилгалогениды, к-ты Льюиса) и электрохим. окисление бисареновых комплексов приводит к катионам [Сr(арен)2]+ (потенциал полуволны для дибензолхрома -0,80 В), при электрохим. окислении при низких т-рах образуются нестабильные двухзарядные катионы [Сr(арен)2]2+; при восстановлении нейтральных комплексов [Сr(арен)2] с электронно-акцепторными заместителями (COR, CH = CHCOR, CN, Ph) образуются анион-радикалы [Сr(арен)2]-. Дибензолхром вступает в реакции металлирования и изотопного обмена водорода в основных средах. В катионных комплексах Сr(I) кислотность связей С — Н на 16-17 порядков выше, чем в бензоле. В хлорзамещенных катионных комплексах [Сr(С6Н5С1)2]+ атом хлора легко замещается на RO-, RNH и др. Обмен ареновых лигандов в [Сr(арен)2] на другой арен протекает в жестких условиях, в присут. АlНаl3 процесс ускоряется; р-ции замещения арена на СО, PF3 требуют высоких т-р и давлений (200 °С, > 30 МПа). Бис(нафталин)хром легко обменивает один или оба лиганда на RNC, СО, PR3, бипиридил.
Дибензолхром получают взаимод. СrС13 с PhMgBr, образующийся [СrРЬ3] в результате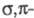 перегруппировки дает смесь [Сr(С6Н6)2], [Сr(С6Н6)Рh2] и [CrPh2]. Для синтеза алкил- и арилзамещ. дибензолхрома используют метод Фишера-Хафнера:
перегруппировки дает смесь [Сr(С6Н6)2], [Сr(С6Н6)Рh2] и [CrPh2]. Для синтеза алкил- и арилзамещ. дибензолхрома используют метод Фишера-Хафнера:
Наиб. универсальный метод синтеза - соконденсация паров Сr и арена при -196 °С в высоком вакууме. Комплексы типа [Сr(С6Н5Х)2] (X = COR, COOR, SiR3, PR2, I) получают металлированием дибензолхрома комплексом бутиллития с тетраметилэтилендиамином с последующим взаимод. с соответствующими реагентами.
Получены сэндвичевые комплексы Сr, содержащие два разных циклич. лиганда. Соед. [Сr(
лиганда. Соед. [Сr( -С5Н5)(
-С5Н5)(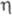 -С6Н6)] чрезвычайно реакционноспособно; при ацилировании в условиях р-ции Фриделя-Крафтса происходит расширение 6-членного кольца до 7-членного и образуется [Cr(
-С6Н6)] чрезвычайно реакционноспособно; при ацилировании в условиях р-ции Фриделя-Крафтса происходит расширение 6-членного кольца до 7-членного и образуется [Cr(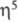 -С5Н5)(
-С5Н5)(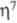 -C7H6R)]+.
-C7H6R)]+.
Известны комплексы Сr с карборанами в качестве лигандов, напр. [Cr(l,2-C2B9H9R2)2]- и [Сr(1,7-С2В9Н11)2]-.
Хроморганические соединения - катализаторы р-ций полимеризации и олигомеризации олефинов (напр., иод-аллильные комплексы), [Сr(арен)2] применяют для получения металлич. и оксидных пленок и покрытий.
Лит.: Магомедов Г. К.-И., в кн.: Методы элементоорганической химии. Подгруппы меди, скандия, титана, ванадия, хрома, марганца. Лантаноиды и актиноиды, под ред. А. Н. Несмеянова, К. А. Кочешкова, кн. 2, М., 1974, с. 477-576; Comprehensive organometallic chemistry, v. 3, Oxf. [а. о.], 1982, p. 783-951, 953-1077.
Л. П. Юрьева.
