Металлокoмплексный катализ
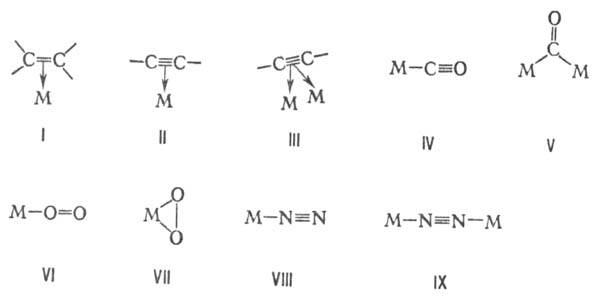
МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗ, основан на взаимод. субстрата с реагентом в координац. сфере комплекса металла. В ряде случаев аналогичен механизму действия ферментов, содержащих атом металла в качестве кофактора. Металлокомплексный катализ может осуществляться под действием гомогенных и гетерогенных металлокомплексных катализаторов. Первые присутствуют в р-ре вместе с реагентами и продуктами р-ции, вторые осуществляют катализ на пов-сти, если они нерастворимы в данной среде или разл. способами нанесены на носитель (полимер или неорг. материал). Такие гетеро-генизир. катализаторы металлокомплексного катализа обладают высокой селективностью, отличаются однородностью активных центров и легкостью их модифицирования, а также термостабильностью, длительным сроком службы и регенерируемостью. Выделяют след. особенности комплексов переходных металлов, определяющих их каталитич. активность. 1) Способность образовывать комплексы с молекулами разл. типов, к-рые, входя в координац. сферу металла-комплексо-образователя, активируются, что обеспечивает легкость их дальнейшего взаимодействия. Известны, напр., комплексы с олефинами (ф-ла I), ацетиленами (II и III), оксидом углерода (IV и V), кислородом (VI и VII), азотом (VIII и IX) и др. (М-атом металла с лигандами).
2) Образование комплексов с координирующим ионом или атомом металла понижает энергию связи реагирующих молекул субстратов, что уменьшает энергии активации их послед. р-ций по сравнению с некоординир. молекулами. Понижение энергии связи при комплексообразовании происходит вследствие частичного переноса электронов со связывающих орбиталей молекул субстратов на своб. орбитали металлов и обратного переноса электрона с заполненных d-орбиталей металла на разрыхляющие (антисвязывающие) орбитали молекул субстратов.
3) В координац. сфере металла молекулы изменяют свои кислотные или основные св-ва и возникает возможность кислотно-основного взаимод. при тех значениях рН, при к-рых своб. молекула не реагирует. Напр., азот в своб. состоянии является исключительно слабым основанием, а в комплексе типа (R3P)4W(N2)2 становится по основности близким к простым эфирам.
4) Если имеется запрет по симметрии мол. орбиталей, препятствующий взаимод. молекул, то при р-ции в координац. сфере металла он может сниматься или значительно ослабляться. Во внутр. сфере процессы, протекающие через переходное состояние, м. б. разрешены и могут протекать с малыми энергиями активации, напр.:
а) окислит. присоединение и обратное ему восстановит. элиминирование молекулы XY:
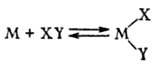
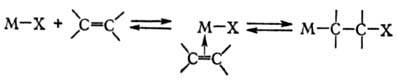
б) внедрение ненасыщенных соед. по связи М—X и обратное ему b-элиминирование:
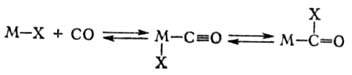
в) обратимое образование металлоцикла из ненасыщенных соед. и карбена в координац. сфере металла:
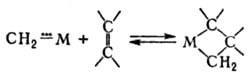
5) Металлокомплексный катализ позволяет осуществить р-ции многоэлектронного окисления и восстановления, в к-рых молекула субстрата в координац. сфере сразу принимает или отдает неск. электронов. При этом облегчаются процессы, в к-рых последоват. перенос электронов затруднен из-за термодинамич. трудностей одно- или двухэлектронных стадий. Особенно благоприятны условия для таких р-ций в случае многоядерных комплексов-кластеров, способных как к одноэлектронному окислению (восстановлению) при взаимод. с реагентом, так и послед, n-электронному окислению (восстановлению) субстрата.
Основные типы реакций, катализируемых комплексами металлов. Гидрирование. Помимо традиц. металлич. катализаторов гидрирования в настоящее время применяют мн. металлокомплексы на основе платиновых металлов. Так, для гидрирования олефинов наиб. часто используют RhCl(PPh3)3 (кат. Уилкинсона), RuHCl(PPh3)3 и RuCl2(PPh3)3. Катализаторы молекулярного и ионного типов на основе комплексов Rh, такие, как HRh(CO)(PPh3)3, Rh2(OCOCH3)4, [Rh(С7Н8)(РРh3+)2]+, {Rh[PPh(CH3)2]3(C7H8}+, [Rh(C7H8)Ph2PCH2CH2PPh2]+ , используют для гидрирования олефинов, ацетиленов, кетонов. Иридиевые и платиновые комплексы в этой р-ции несколько менее активны; среди них наиб. часто применяют комплексы IrCl(CO)(PPh3)2 и [Pt(SnCl3)5]3-. Катализаторами гидрирования являются также комплексы неплатиновых металлов, образующиеся, напр., при действии сильных восстановителей, таких, как Аl(С2Н5)3 и др., на соед. Со, Ti и Zr (т. наз. катализаторы Циглера - Натты), а также гидриды металлоценов, напр. (h-C5H5)2MH, где М = Lu, Ti, Mb.
Синтезы с участием оксида углерода. Для присоединения СО и Н2 к олефинам с образованием альдегидов (гидроформилирование олефинов) в пром. масштабе применяют октакарбонил Со, к-рый в условиях катализа пре-вращ. в гидридотетракарбонильный комплекс (см. Гидроформилирование): Со2(СО)8 + Н2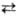 2[НСо(СО)4]. Все большее применение в этой р-ции находят фосфиновые и фосфит-ные комплексы Rh, напр. HRh(CO)(PPh3)3. В зависимости от реагентов и условий р-ции синтезы на основе СО могут приводить к образованию альдегидов, кетонов, высших спиртов, карбоновых к-т и их эфиров. Так, гидрокарбо-нилирование осуществляется в присутствии Ni(CO)4, напр.: RCH=CH2 + СО + Н2О
2[НСо(СО)4]. Все большее применение в этой р-ции находят фосфиновые и фосфит-ные комплексы Rh, напр. HRh(CO)(PPh3)3. В зависимости от реагентов и условий р-ции синтезы на основе СО могут приводить к образованию альдегидов, кетонов, высших спиртов, карбоновых к-т и их эфиров. Так, гидрокарбо-нилирование осуществляется в присутствии Ni(CO)4, напр.: RCH=CH2 + СО + Н2О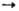 RCH2CH2COOH + + RCH(COOH)CH3. Карбонилирование спиртов катализируется соед. Rh, напр. уксусную к-ту получают из СН3ОН и СО в присут. RhCl3.3H2O (сокатализатор HI).
RCH2CH2COOH + + RCH(COOH)CH3. Карбонилирование спиртов катализируется соед. Rh, напр. уксусную к-ту получают из СН3ОН и СО в присут. RhCl3.3H2O (сокатализатор HI).
П о л и м е р и з а ц и я, д и м е р и з а ц и я, о л и г о м е р и з а ц и я о л е ф и н о в и ацетиленов. Для этих р-ций наиб. часто используют катализаторы, образующиеся при взаимод. алкильных производных Al, Li, Mo, Sn и др. с соед. переходных металлов (см. Циглера-Натты катализаторы).
Так, при взаимод. Аl(С2Н5)3 с TiCl4 и TiCl3 в углеводородных р-рителях образуются гетерог. катализаторы полимеризации этилена и a-олефинов; при взаимод. АlСl(С2Н5)2 с (h-C5H5)2TiCl2-гомогенные. Полимеризация пропилена и др. a-олефинов на таких катализаторах происходит с образованием стереорегулярных полимеров. Комплексы, образующиеся при взаимод. Аl(С2Н5)3 с Ti(OC4H9)4, катализируют димеризацию этилена. Для димеризации и олигомеризации олефинов применяют также комплексы Ni, образующиеся при взаимод. NiCl2, Ni[P(OPh)3]4 с галогени-дами и алкилгалогенидами Аl.
Бинарные системы СоСl2-АlСl(С2Н5)2, VСl3(ТГФ)3-АlСl(С2Н5)2 используют для получения стереорегулярных бутадиеновых каучуков. В присут. первого комплекса образуется полимер, содержащий 93-98% звеньев структуры 1,4-цис, второго-содержащий до 99% 1,4-транс.
Олигомеризация ацетиленов в циклооктатетраен или производные бензола протекает в присут. комплексов Ni, Со, Pd, Rh, Ir, таких, как Ni(CO)4, Co(CO)2(h-C5H5)2, PdCl2(PhCN)2, RhCl(PPh3)3, IrCl(CO)(PPh3)2. При контакте газообразного ацетилена с поверхностью р-ра гомог. катализатора, приготовленного смешением Аl(С2Н5)3 и Ti(OC4H9)4 или фосфиновых комплексов Ni и Со с NaBH4, получается кристаллич. циc-полиацетилен (поливинилен).
О к и с л е н и е у г л е в о д о р о д о в в к а р б о н и л ь н ы е с о е д и н е н и я и э п о к с и д ы. Окисление этилена в ацетальдегид кислородом воздуха в водном р-ре НСl (т. наз. Вакер-процесс) катализируется комплексами Pd (сокатализатор - соль Сu). Окисление этилена на аналогичном катализаторе в присут. СН3СООН приводит к винилацетату. Синтез пропиленоксида из пропилена осуществляют с использованием гексакарбонила молибдена Мо(СО)6 или ацетилацетоната ванадила VO(C5H7O2)2. Эпоксидирование олефинов действием Н2О2 или орг. пероксидов катализируется комплексами Мо, а также пероксимолибденовыми и пероксиволъфрамовыми соединениями. Радикально-цепное окисление углеводородов кислородом осуществляется в присут. солей переходных металлов, таких, как Со(П), Мn(II) и др. Таким образом проводят синтез терафталевой к-ты из n-ксилола, уксусной к-ты из бутана и т.п. Все эти процессы находят широкое применение в пром-сти (см. также Катализаторы окисления).
М е т а т е з и с о л е ф и н о в и а ц е т и л е н о в. Р-ции типа СН2=СН2 + PhCH=CHPh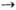 2PhCH=CH2 катализируются комплексами переходных металлов VI и VII групп. Катализаторы - продукты взаимод. WCl6, МоСl5, W(CO)6, ReCl5 и др. с алкильными производными металлов-AlR3, LiR, SnR4, RMgX и др.
2PhCH=CH2 катализируются комплексами переходных металлов VI и VII групп. Катализаторы - продукты взаимод. WCl6, МоСl5, W(CO)6, ReCl5 и др. с алкильными производными металлов-AlR3, LiR, SnR4, RMgX и др.
Г и д р о с и л и д и р о в а н и е. Присоединение фрагмента Si—Н к ненасыщенным соед. по р-ции: R3SiH + R'R:C=CH2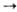 R'R:CHCH2SiR3 протекает в присут. H2PtCl6, RhCl(PPh3)3, Ni[P(OPh)3]4, Co(C5H7O2) и др.; находит применение в произ-ве силиконовых полимеров.
R'R:CHCH2SiR3 протекает в присут. H2PtCl6, RhCl(PPh3)3, Ni[P(OPh)3]4, Co(C5H7O2) и др.; находит применение в произ-ве силиконовых полимеров.
Фиксация азота. Восстановление N2 до нитридных производных при комнатной т-ре происходит в присут. восстановителей (LiR, RMgX, AlR3 и др.) и соед. переходных металлов (Ti, V, Cr, Mo, W, Fe и др.). В протонных средах в присут. Мо(Ш) или V(II), напр. V(OH2), N2 образует гидразин и аммиак. В случае катализаторов на основе Мо(Ш) для протекания р-ции необходимо присутствие в смеси внеш. восстановителя, в качестве к-рого м. б. использованы Ti(OH)3, Cr(OH)2 или Na-Hg; при электрохим. восстановлении-ртутный катод.
А к т и в а ц и я а л к а н о в в р а с т в о р а х. Комплексы Pt при 80-120 °С катализируют изотопный обмен насыщ. углеводородов с D2O. Эти же комплексы используют при окислении алканов; так, в водных р-рах в присут. PtCl24 и PtCl2-6 из СН4 образуется СН3Сl и СН3ОН. Катализаторы Циглера - Натты способствуют гидрометили-рованию ненасыщенных соед.: в присут. комплекса Ni метан с ацетиленом образуют пропилен. Комплексы Re, Ir, Ru, Os способствуют дегидрированию алканов до алкенов, сопряженному с гидрированием акцептора водорода, напр. трет-бутилэтилена. В присут. фосфинкарбонильных комплексов Rh из алканов и СО образуются альдегиды.
Механизм металлокомплексного катализа. В случае гидрирования типичный механизм элементарной стадии р-ции состоит из окислительного присоединения Н2 к комплексу (ур-ние 1), комплексо-образования олефина и внедрения его по связи М—Н (2), восстановительного элиминирования алкана (3):
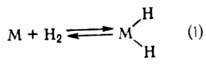
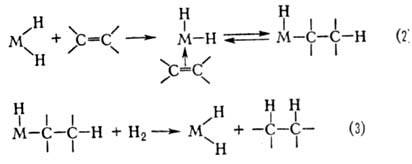
Стадия (2) является ключевой также в р-циях изомеризации, гидросилилирования и гидроформилирования олефинов.
Полимеризация протекает по механизму последоват. внедрения молекул олефина по связи М-С:
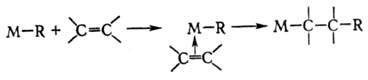
Метатезис обычно протекает через стадию образования карбеновых комплексов металла с олефинами и обратимое выделение металлокомплексов (см. Метатезис). При восстановит. фиксации азота в протонных средах внеш. восстановитель (напр., катод) восстанавливает соед. Mo(V) или Mo(VI) до Мо(Ш) с образованием кластера, способного координировать молекулы N2 и переводить их в гидразин путем четырехэлектронного восстановления.
Развитие металлокомплексного катализа, в т. ч. с использованием принципа действия ферментов, позволяет создавать новые практически важные каталитич. процессы, протекающие с высокой селективностью по осн. продукту, высоким выходом, низкими энергозатратами и малым загрязнением окружающей среды.
Исп. литература для статьи «МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗ»: Джеймс Б., Гомогенное гидрирование, пер. с англ., М., 1976; Хенрици-Оливэ Г., Оливэ С., Координация и катализ, пер. с англ., М., 1980; М., 1981; Мастере К., Гомогенный катализ переходными металлами, пер. с англ., М., 1983; Накамура А., Цуцуи М., Принципы и применение гомогенного катализа, пер. с япон., М., 1983; Хартли Ф., Закрепленные металло-комплексы, пер. с англ., М., 1989; "Успехи химии", 1990, т. 59, в. 12; Shilov A. E., Activation of saturated hydrocarbons by transition metal complexes, Dordrecht, 1984.
A. E. Шилов.
