Олово
OЛОВО (Stannum)
Sn, хим. элемент IV гр. периодич. системы, ат. н. 50, ат. м. 118,710. Прир.
олово состоит из десяти изотопов: 112Sn(0,96%), 114Sn(0,66%),
115Sn(0,35%), 116Sn(14,30%), 117Sn(7,61%),
118Sn(24,03%), 119Sn(8,58%), 120Sn(32,85%),
122Sn(4,72%), 124Sn(5,94%). Последний изотоп слабо радиоактивен
(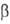 -излучатель,
T1/2 > 1016 — 1017 лет). Конфигурация
внеш. электронной оболочки атома 5s25p2; степени
окисления +2 и +4; энергия ионизации при после-доват. переходе от Sn° к
Sn5+ соотв. 7,3439, 14,6324, 30,502, 40,73 и 72,3 эВ; электроотрицательностъ
по Полингу 1,8; атомный радиус 0,158 нм, ионные радиусы (в скобках указаны координац.
числа) для Sn2+ 0,136 нм (8), Sn4+ 0,069 нм (4), 0,076
нм (5), 0,083 нм (6), 0,089_нм (7) и 0,095 нм (8).
-излучатель,
T1/2 > 1016 — 1017 лет). Конфигурация
внеш. электронной оболочки атома 5s25p2; степени
окисления +2 и +4; энергия ионизации при после-доват. переходе от Sn° к
Sn5+ соотв. 7,3439, 14,6324, 30,502, 40,73 и 72,3 эВ; электроотрицательностъ
по Полингу 1,8; атомный радиус 0,158 нм, ионные радиусы (в скобках указаны координац.
числа) для Sn2+ 0,136 нм (8), Sn4+ 0,069 нм (4), 0,076
нм (5), 0,083 нм (6), 0,089_нм (7) и 0,095 нм (8).
Содержание олова в земной
коре 8·10-3 % по массе. Самородное олово в природе не встречается. Известно
16 минералов олова. Пром. применение имеют касситерит (оловянный камень) SnO2
и в меньшей степени -станнин (оловянный колчедан) Cu2FeSnS4.
Оловянные руды подразделяются на пегматитовые, кварцево-касситеритовые и сульфидно-касситерито-вые.
Касситерит встречается также в россыпях, где он концентрируется благодаря высокой
плотности. Месторождения олова находятся в СССР, Малайзии, Индонезии, Таиланде,
Заире, Нигерии, Боливии, Бразилии, КНР, Австралии.
Свойства. Олово-серебристо-белый
блестящий металл, обладающий незначит. твердостью, но большой пластичностью,
ковкостью и легкоплавкостью. Ниже 13,2°С устойчива a-модификация (серое
олово) с кубич. решёткой типа алмаза, а = 0,646 нм, z = 8, пространств,
группа Fd3m, плотн. 5,75 г/см3; выше 13,2°С устойчива
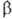 -модификация
(белое олово) с тетрагон, кристаллич. решеткой, а — 0,58197 нм, г = 0,3175
нм, z = 4, пространств, группа 14/amd, плотн. 7,28 г/см3;
-модификация
(белое олово) с тетрагон, кристаллич. решеткой, а — 0,58197 нм, г = 0,3175
нм, z = 4, пространств, группа 14/amd, плотн. 7,28 г/см3;
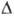 H
перехода
H
перехода 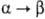 2,08 кДж/моль. При переходе
2,08 кДж/моль. При переходе 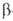 -формы в
-формы в 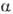 значительно
(на 25%) увеличивается уд. объем металла, к-рый при этом рассыпается в белый
порошок; процесс резко ускоряется при наличии зародышей a-Sn ("оловянная
чума"). Т. пл. 231,9oС, т. кип.
значительно
(на 25%) увеличивается уд. объем металла, к-рый при этом рассыпается в белый
порошок; процесс резко ускоряется при наличии зародышей a-Sn ("оловянная
чума"). Т. пл. 231,9oС, т. кип. 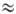 2600
°С; для белого олова:
2600
°С; для белого олова: 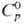 27,11
Дж/моль · К),
27,11
Дж/моль · К), 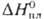 7,2 кДж/моль,
7,2 кДж/моль,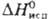 296 кДж/моль,
296 кДж/моль, 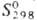 51,58 Дж/моль·К); для серого олова:
51,58 Дж/моль·К); для серого олова: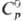 25,79 Дж/моль·К),
25,79 Дж/моль·К), 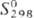 44,16 Дж/моль·К); давление пара 9.86·10-4 Па (1000 К), 1,1 Па (1300
К), 22,6 Па (1500 К), 4,08 кПа (2000 К), 91кПа (2550 К); температурный коэф.
линейного расширения 1,99·10-5 К (273 К), 2,38·10-5 К-1
(373 К); теплопроводность 0,6526 Вт/см·К) при 293 К; r 1,15·10-5 Ом·см
(20°С). Белое олово слабо парамагнитно, атомная магн. восприимчивость
44,16 Дж/моль·К); давление пара 9.86·10-4 Па (1000 К), 1,1 Па (1300
К), 22,6 Па (1500 К), 4,08 кПа (2000 К), 91кПа (2550 К); температурный коэф.
линейного расширения 1,99·10-5 К (273 К), 2,38·10-5 К-1
(373 К); теплопроводность 0,6526 Вт/см·К) при 293 К; r 1,15·10-5 Ом·см
(20°С). Белое олово слабо парамагнитно, атомная магн. восприимчивость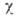 + 4.5· 10-6 (303 К); при т-ре плавления оно становится диамагнитным,
+ 4.5· 10-6 (303 К); при т-ре плавления оно становится диамагнитным,
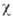 — 5,1
· 10-6, процесс обратим. Серое олово диамагнитно,
— 5,1
· 10-6, процесс обратим. Серое олово диамагнитно, 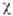 —
3,7·10-5 (293 К). Т-ра перехода в свсрхпроводящее состояние 3,72
К.
—
3,7·10-5 (293 К). Т-ра перехода в свсрхпроводящее состояние 3,72
К.
Мех. св-ва олова зависят от
его чистоты и т-ры обработки, при 20oС 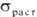 10-40 МПа; относит. удлинение 40%; модуль упругости 55 ГПа, твердость по Бринеллю
10-40 МПа; относит. удлинение 40%; модуль упругости 55 ГПа, твердость по Бринеллю
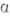 -Sn 62
МПа,
-Sn 62
МПа, 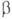 -Sn
152 МПа.
-Sn
152 МПа.
При обычных условиях олово
устойчиво к хим. воздействиям. Стандартный электродный потенциал для Sn/Sn2+
в кислой среде
—0,136 В, в щелочной среде для системы 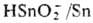 ~ 0,3 В. Заметное окисление олова на воздухе наблюдается при 150°С, с повышением
т-ры скорость окисления увеличивается. Тонкая поверхностная пленка оксидов делает
олово устойчивым и по отношению к воде. В разб. соляной к-те олово раств. очень медленно,
в концентрированной - быстро (особенно при нагр.), с образованием хлороловянных
к-т. С разб. H2SO4 олово почти не реагирует, с конц. H2SO4
взаимод. медленно. В разб. HNO3 раств. с образованием нитрата Sn(NO3)2.
Конц. HNO3 энергично взаимод. с оловом, давая нерастворимую в воде р-оловянную
к-ту (см. ниже). Олово очень хорошо раств. в царской водке. С р-рами щелочей медленно
реагирует даже на холоду, скорость р-ции значительно повышается в присут. воздуха;
при_этом в р-ре образуются гидроксостаннат-ионы [Sn(OH)6]2-.
Растворение олова в р-рах щелочей используют при его регенерации (после растворения
металл выделяют электролитически). С хлором и бромом олово взаимод. при обычной
т-ре, с I2-при слабом нагревании. Р-ция с F2 протекает
при обычной т-ре чрезвычайно медленно, при 100 °С очень бурно, с появлением
пламени. При нагревании олово энергично реагирует с S, Se, Те, Р, а с С, N2,
H2, Si, В, Mo, Os, Re и W непосредственно не взаимодействует. Образует
с Al, Bi, Cd, Ca, Ge, In, Pb, Si, Те и Zn эвтектич. смеси; в заметных кол-вах
раств. в твердом состоянии Bi, Cd, In, Pb, Sb и Zn. Мн. металлы в твердом олове
раств. в очень малых кол-вах, но образуют с ним интерметаллиды. О наиб. важных
соединений олова см. Олова галогениды, Олова оксиды, Олова халькогениды, Оловоорганические
соединения.
~ 0,3 В. Заметное окисление олова на воздухе наблюдается при 150°С, с повышением
т-ры скорость окисления увеличивается. Тонкая поверхностная пленка оксидов делает
олово устойчивым и по отношению к воде. В разб. соляной к-те олово раств. очень медленно,
в концентрированной - быстро (особенно при нагр.), с образованием хлороловянных
к-т. С разб. H2SO4 олово почти не реагирует, с конц. H2SO4
взаимод. медленно. В разб. HNO3 раств. с образованием нитрата Sn(NO3)2.
Конц. HNO3 энергично взаимод. с оловом, давая нерастворимую в воде р-оловянную
к-ту (см. ниже). Олово очень хорошо раств. в царской водке. С р-рами щелочей медленно
реагирует даже на холоду, скорость р-ции значительно повышается в присут. воздуха;
при_этом в р-ре образуются гидроксостаннат-ионы [Sn(OH)6]2-.
Растворение олова в р-рах щелочей используют при его регенерации (после растворения
металл выделяют электролитически). С хлором и бромом олово взаимод. при обычной
т-ре, с I2-при слабом нагревании. Р-ция с F2 протекает
при обычной т-ре чрезвычайно медленно, при 100 °С очень бурно, с появлением
пламени. При нагревании олово энергично реагирует с S, Se, Те, Р, а с С, N2,
H2, Si, В, Mo, Os, Re и W непосредственно не взаимодействует. Образует
с Al, Bi, Cd, Ca, Ge, In, Pb, Si, Те и Zn эвтектич. смеси; в заметных кол-вах
раств. в твердом состоянии Bi, Cd, In, Pb, Sb и Zn. Мн. металлы в твердом олове
раств. в очень малых кол-вах, но образуют с ним интерметаллиды. О наиб. важных
соединений олова см. Олова галогениды, Олова оксиды, Олова халькогениды, Оловоорганические
соединения.
Для соединений олова, особенно
в степени окисления +4, характерна большая склонность к гидролизу. Оловянные
к-ты, к-рые м. б. представлены как гидратированные формы SnO2, имеют
неопределенный состав, ближе всего отвечающий ф-ле SnO2 · 1,8 Н2О.
Известны две модификации - a-и b-оловянная к-ты. a-Оловянная (ортооловянная)
к-та образуется при действии NH3 на SnCl4 или действии
к-т на Na2[Sn(OH)6]. 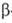 -Оловянная
(метаоловянная) к-та образуется при взаимод. металлического олова с конц. HNO3.
Гид-роксостаннаты M2[Sn(OH)6], где М = Na, К,-бесцв. твердые
в-ва, дающие щелочную р-цию в воде; при их дегидратации получают SnO2
и ортостаннаты, напр. Na2SnO3, используемый при крашении
тканей.
-Оловянная
(метаоловянная) к-та образуется при взаимод. металлического олова с конц. HNO3.
Гид-роксостаннаты M2[Sn(OH)6], где М = Na, К,-бесцв. твердые
в-ва, дающие щелочную р-цию в воде; при их дегидратации получают SnO2
и ортостаннаты, напр. Na2SnO3, используемый при крашении
тканей.
Сульфат олова(IV) Sn(SO4)2
выделяется из р-ра свежеосажденного гидрата SnO2 в разб. H2SO4
в виде бесцв. кристаллов дигидрата. Нитрат олова(IV) Sn(NO3)4-бесцв.
твердое в-во; плотн. 2,65 г/см3; разлагается при 50 °С; получают
взаимод. SnO4 с N2O5.
Олово образует с Н2
нестабильный гидрид (станнан) SnH4-бесцв. газ; т. пл. — 150°С,
т. кип. —52 °С; медленно разлагается уже при 0 oС на элементы,
при 150 °С - быстро; по ядовитости приближается к AsH3; получают
р-цией SnCl4 с Li [AlH4]. Его образование также наблюдается
при восстановлении солей олова цинком в солянокислой среде.
Соед. Sn(II) легко окисляются
и поэтому их используют как восстановители. Большинство солей бесцв., хорошо
раств. в воде. При добавлении к свежеприготовл. р-ру соли Sn(II) гидроксида
щелочного металла или аммония образуется бесцв. осадок гидроксида Sn(OH)2,
к-рый при дегидратации переходит в SnO. Получены: гидроксостанна-ты(П),
напр. Na[Sn(OH)3], Ba[Sn(OH)3]2- Сульфат олова(II)
SnSO4-бесцв. кристаллы; т. пл. 360 °С (с разл.); плотн. 4,18
г/см3; р-римость в воде 15,9% по массе (19 °С) и 15,3% (100°С);
компонент электролита при лужении. Нитрат олова (II) Sn(NO3)2
· 20Н2О (плотн. 1,2 г/см3) осаждается из р-ра SnO в HNO3
при охлаждении до — 20oС в виде бесцв. расплывающихся кристаллов.
Несколько устойчивее окси-нитрат Sn2O(NO3)2,
к-рый м.б. нагрет до 100°С без разложения. Практически не раств. в воде
фосфаты Sn3(PO4)2 и Sn(H2PO4)2.
Пирофосфат Sn2P2O7 имеет г. пл. 400°С,
плотн. 4.01 г/см3. Арсенат SnHAsO4·0,5H2O имеет
плотн. 4.29 г/см3. Перхлорат олова Sn(ClO4)2 м.б.
получен электролизом р-ра AgClO4 в ацетонитриле с анодом из олова.
Получают в пром-сти: формиат
Sn(OCOH)2 [т. .пл. 198°С (с разл.), плотн. 2,96 г/см3];
ацетат Sn(OCOCH3)2 (т.пл.
182°С, т.кип. 240 °С, плотн. 2,11 г/см3); оксалат SnC2O4
[т.пл. 280°С (с разл.), плотн. 3,56 г/см3]; тартрат Sn[OCOCH(OH)CH(OH)COO]
(т.пл. 280 °С, плотн. 2,60 г/см3); стеарат Sn[OCO(CH2]16CH3)2
(т.пл. 90°С, плотн. 1,05 г/см3) и др. Олеат-катализатор полимеризации,
антиоксидант; оксалат применяют при крашении и печатании тканей, напр, для перевода
красителя в лейкоформу; тартрат - антиоксидант, антисептик в текстильной пром-сти.
Получение. Добычу
олова ведут из руд с содержанием олова более 0,1%. Часто используют россыпи, полученные
после преобразования первичных руд в прир. условиях, с содержанием Sn 0,01%.
Руды обогащают гравитац. и флотогра-витац. методами, магн. сепарацией, флотацией,
а россыпи-преим. гравитац. методом. Получают концентраты с содержанием олова 40-70%.
Первичные концентраты вновь обогащают теми же способами после дополнит. измельчения,
иногда-с применением обжига, электростатич. или магн. сепарации. Для удаления
примесей S и As концентраты обжигают при 600-700 °С, для удаления W, Bi,
Fe и др. примесей их выщелачивают конц. соляной к-той при 110-130°С в автоклаве.
Оловянный концентрат затем сушат и подвергают восстановит. плавке с углем и
флюсами либо с Аl или Zn в электрич. печах. Образующиеся при восстановлении
касситерита шлаки богаты оловом, поэтому они подвергаются доработке - повторной
плавке и фьюмингованию с углем и пиритом (в расплавл. шлак вводят пирит и вдувают
угольную пыль; пары восстановленного олова в надшлаковом пространстве вновь окисляются
и уносятся в виде оксидов, осаждаясь в пылеуловителях). Черновое олово, содержащее
95% Sn, рафинируют: Fe и Си удаляют добавлением в жидкое олово угля и S; As и Sb
связывают добавкой Al; Pb и Bi отгоняют из олова в вакууме при 1100°С. Обычная
чистота олова 99,8-99,9%. Особо чистое олово для полупроводниковой техники получают
дополнит. очисткой - электролизом и зонной плавкой, восстановлением очищенных
хлоридов. Вторичное олово извлекают из отходов белой жести и сплавов, напр, бронз.
Для переработки бедных концентратов перспективно применение способов, основанных
на высокой летучести хлоридов олова и их способности восстанавливаться Аl, Mg,
Zn.
Определение. Олово относится
к аналит. группе элементов, осаждаемых H2S в кислой среде и образующих
с сульфидами Na и NH4 р-римые соли. Осаждение сероводородом из кислого
р-ра позволяет отделить олово от Fe и ряда др. элементов, не осаждающихся в этих
условиях. Очень чувствительная р-ция на соли олова-взаимод. с неск. каплями р-ра
хлорида Аи в кислой среде, в результате чего появляется темно-пурпурное окрашивание
(кассиев золотой пурпур). Все соединения олова при оглавлении с Na2O2
дают р-римые станнаты, а после подкисления р-ра-соли Sn(IV), к-рые восстанавливают
Fe, Al или Pb и титруют иодометрически. При растворении сплавов в HNO3
часто удается количественно выделить олово в виде осадка оловянной к-ты, к-рую
прокаливают и взвешивают в виде SnO2. Метод отделения олова перегонкой
основан на летучести SnCl4. Колориметрически малые кол-ва олова определяют
по синей окраске с силикомолибденовой к-той или по красной окраске с дитио-лом.
Комплексонометрическое титрование позволяет определить олово в присут. Pb, Ni,
Zn, Cd, Mn, Ag. Олово определяют также спектральными методами.
Применение. Олово-компонент
сплавов (ок. 59% используемого олова) с Си (бронзы), Си и Zn (латунь), Sb (баббит),
Zr (для атомных реакторов), Ti (для турбин), Nb (для сверхпроводников), Pb (для
припоев) и др. (см. Олова сплавы). Его используют для нанесения
защитных покрытий на металлы (ок. 33%), в т.ч. для произ-ва белой жести, как
компонент композиц. материалов, восстановитель ионов металлов; сетки из олова служат
для очистки металлургич. газов от паров ртути благодаря образованию амальгамы.
Олово применяют также в виде фольги, для приготовления детален измерит, приборов,
органных труб, посуды, художеств. изделий. Искусств. радиоактивный изотоп 119Sn
(T1/2 1759 сут)-источник 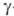 -излучения
в
-излучения
в 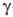 -спектроскопии.
-спектроскопии.
При ингаляции паров или
пылей металлич. олова в производств. условиях развивается пневмокониоз (станноз),
острые отравления не наблюдаются. В атм. воздухе временно допустимая концентрация
SnO, SnO2 и SnSO4 0,05 мг/м3, для SnCl макс.
разовая ПДК 0,5 мг/м3, среднесуточная 0,05 мг/м3. ПДК
олова в пищ. продуктах (мг/кг): в рыбных, мясных и овощах 200,0, молочных, фруктах
и соках 100,0.
Мировое произ-во олова (без
СССР) ок. 200 тыс. т/год (1982). Общие запасы олова в капиталистич. и развивающихся
странах в 1981 составляли 7,36 млн. т, из них разведанные - 2,92 млн. т, в т.
ч. в Индонезии-0,74, Малайзии-0,60 млн. т. В 1983 была организована Ассоциация
стран - производителей олова, куда вошли Малайзия, Индонезия, Таиланд, Боливия,
Австралия, Нигерия и Заир, контролирующие более 90% суммарного выпуска олова в
капиталистич. странах. Общее потребление рафинированного олова в развитых капиталистич.
странах в 1982 составило 154,2 тыс. т.
Сплавы олова с медью-бронзы
были известны более чем за 4 тыс. лет до н. э. Из чистого олова в древности изготовляли
украшения, посуду, утварь.
Лит.: Смиваковский
В. Б., Аналитическая химия олова, М., 1975; Сев-рюков Н.Н., Кузьмин Б. А., Челинцев
Е.В., Общая металлургия, 3 изд., М., 1976; Большаков К. А.. Федоров П. И., Химия
и технология малых металлов, М., 1984; Жарков В. А., Козырев В. С., Федоров
Т. Ф., в кн.: Итоги науки и техники. Сер. Металлургия цветных металов, т. 15,
М., 1985, с. 3-114; Си sack P. A., Smith P.J., "Speciality Inorganic Chemicals",
1981, № 40, p. 285-310; Kirk-Othmer encyclopedia, 3 ed., v. 23, N.Y., 1983,
p. 18-77.
Н. П. Дергачева.