Оловоорганические соединения
ОЛОВООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (органостан-наны), содержат связь Sn—С. Наиб. распространены соед. Sn(IV), имеются отдельные примеры соед. Sn(II). Осн. типы оловоорганических соединений Sn(IV): R4Sn, R3SnX, R2SnX2, RSnX3 (X = Hal, псевдогалоген, OH, OR' NR'2, SR', OCOR', H, OSnR3, SnR3, металл и др.), (R,SnO)n, (R2SnS)n, [RSnO(OH)]n и др. Для оловоорганических соединений типа R4Sn, R3Sn—SnR3, (R3Sn)2O, оловоорг. гидридов и сульфидов, олигомерных оловоорганических соединений, напр. [(C4H9)2Sn(OCH3)2]2, характерно тетраэдрич. строение с sp3-гибридизов. орбита-лями Sn; для оловоорганических соединений с более электроотрицат. заместителями -обычно тригонально-бипирамидальная (sp3d-гибридизация) или октаэдрич. (sp3d2)структура с 5- и 6-координац. Sn. Повышение координац. числа Sn может происходить благодаря координации с внеш. лигандом, напр. соед. ф-л I и II, внутримол. координации (III) и самоассоциации (IV):
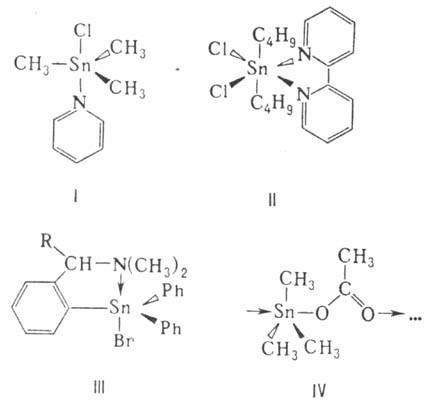
Известны комплексы оловоорганических соединений с координац. числом более 6, напр. комплекс (CH3)2Sn(NCS)2 с трипиридилом-7-коор-динационный пентагонально-бипирамидальный, комплекс PhSnCl3 с 4 молекулами морфолина-8-координационный.
Для определения структуры оловоорганических соединений используют методы ИК, УФ спектроскопии, рентгеноструктурный анализ, а также спектроскопии ЯМР 119Sn и мёссбауэровскую, к-рые позволяют определять координац. число Sn и взаимное расположение лигандов в оловоорганических соединениях.
Соединения Sn(IV). Оловоорганические соединения типа R4Sn-6eсцв.. жидкости (R-алкил, винил, этинил) или твердые в-ва (R-арил), раств. в орг. р-рителях, термически стабильны (до 200 °С), относительно устойчивы по отношению к воде и кислороду воздуха; RR'R:R'''Sn хиральны. Для соед. этого типа характерны р-ции разрыва связи Sn—С под действием электроф. агентов, часто с нуклеоф. содействием, напр.:
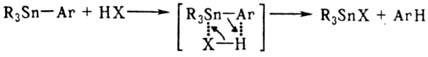
Гомолиз связи Sn—С менее характерен, может протекать под действием Вг2,I2, N-бромсукцинимида и др. Р-ция R4Sn с галогенидами Sn (р-ция Кочешкова) в зависимости от соотношения реагентов и т-ры приводит к хлоридам три-, ди- и моноорганостаннанов: при соотношении 3:1 и 200 °С образуются R3SnHal, при 1:1 и 200°C-R2SnHal2, при 1:3 и 100°C-RSnHal3. Галогены отщепляют орг. радикал от соед. R4Sn; легкость отщепления увеличивается в ряду: алкил < винил < бензил < фенил. Соед., содержащие 2,3-не-насыщ. радикалы, легче подвергаются гетеро- и гомолитич. разрыву связи Sn—С из-за ст, я-сопряжения.
В пром-сти R4Sn получают взаимод. SnCl4 с другими металлоорг. соед., чаще всего RMgX, при нагр. в ТГФ или толуоле:
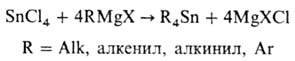
Соед. R4Sn (R = С4Н9 и С8Н17) получают р-цией R3Al и SnCl4 в присут. простых эфиров; (CH3)4Sn-электролизом СН3Сl и SnCl4 в расплаве NaCl-AlCl3.
Иногда используют гидростаннилирование (присоединение R3SnH к алкенам и алкинам), особенно для синтеза функционально замещенных оловоорганических соединений; при этом образуются (b-аддукты, напр. 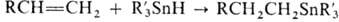 ; 1,3-диены образуют продукты 1,4-присоединения.
; 1,3-диены образуют продукты 1,4-присоединения.
Оловоорганические соединения, содержащие циклопентадиенильный или этинильный радикалы, а также радикалы, замещенные в а-положении на функц. группы, получают взаимод. станниламинов с СН-кислотами, напр.:
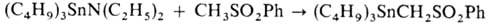
Оловоорганические соединения типа RnSnX4_n (X = Hal или псевдогалоген, п = 1 — 3) - жидкие или твердые в-ва, раств. в орг. р-рителях (кроме фторидов), соед. при R = СН3 раств. в воде. В газовой фазе и инертных р-рителях-тетраэдрич. мономеры, в твердом виде имеют тенденцию увеличивать координац. число атома Sn до 5 (R3SnX) или 6 (R2SnX2 и R2SnX3) благодаря ассоциации через мостиковые атомы X. С увеличением объема R склонность к ассоциации уменьшается.
Соед. R3SnX гидролитически устойчивы, R2SnX2 гидроли-зуются до оксидов R2SnO [для оловоорганических соединений с объемными R можно выделить промежуточные R2Sn(OH)X]; RSnX3 образуют на воздухе гидраты RSn(OH)X2 · Н2О.
Атомы X в RnSnX4 весьма подвижны и легко замещаются на атомы металлов Iа и IIа гр., водорода (при действии LiAlH4), алкил- (при действии RMgX и др.), алкокси-, алкилтио-, аминогруппы и др.; при взаимод. с оловоорг. гидридами образуются несимметричные дистаннаны, напр.
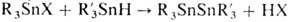 . Р-ция со щелочами приводит к оловоорг. гидроксидам, оксидам, полимерным оксидам и органостанноновым к-там, напр.:
. Р-ция со щелочами приводит к оловоорг. гидроксидам, оксидам, полимерным оксидам и органостанноновым к-там, напр.:
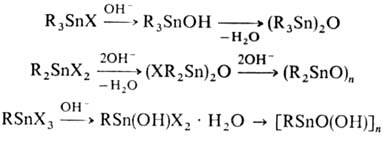
С разл. лигандами образуют комплексы R3SnX • L, R2SnX2 • L2, RSnX3 • L2.
В пром-сти соед. R4SnX4-n получают прямыми методами из орг. галогенидов и металлич. Sn в присут. катализаторов (напр., Ph4SbCl или Ph3Sb) либо алкилированием галогенидов Sn магний- или литийорг. соед., напр.: SnX4+nRMgX
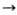 RnSnX4_n + nMgX2.
RnSnX4_n + nMgX2.
Соед. RnSnHal4-n м. б. получены также деалкилированием R4Sn или RnSnR'4_n при действии SnCl4 [применяется для пром. синтеза (C4H9)3SnCl, (C4H9)2SnCl2, C8H17SnCl2 и Ph3SnCl], неорг. солей (TiCl4, AlCl3, BiCl3, HgCl2 и др.), галогенов и галогеноводородных к-т. Органооловогалоге-ниды образуются при действии галогеноводорода на R3SnOH, R2SnO и RSnOOH, галогена, галогеноводорода или алкил-галогенида на оловоорг. гидриды или галогена на оловоорганические соединения со связями Sn—Sn.
Диарилоловогалогениды получают разложением двойных солей арилдиазонийхлорида с SnCl4:
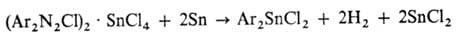
Соед. RnSnX4-n(X = CN, SCN, N3 и др.) получают действием соответствующих к-т на R3SnOH, (R3Sn)2O или R3SnNR2 или их солей на RnSnCl4_n.
Кислородсодержащие оловоорг. соединения. Гидроксиды R3SnOH-обычно твердые в-ва, обладают резким запахом, раств. в орг. р-рителях (низшие члены ряда раств. в воде); (CH3)3SnOH в р-ре-димер, в твердом виде-полимер. При плавлении или растворении (за исключением R3SnOH, где R = СН3, Аr или объемный алкил) подвергаются спонтанной обратимой дегидратации:
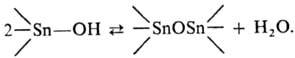
Получают гидроксиды щелочным гидролизом R3SnX (X = Hal, OCOR', OR', NR2 и др).
Оксиды R2SnO-аморфные твердые нерастворимые в-ва, разлагаются выше 200 °С, имеют разветвленную полимерную структуру, их гидраты R2Sn(OH)2 нестойки; (R3Sn)2O-жидкости, перегоняющиеся в вакууме, [(CH3)2Sn]2O в отличие от др. оксидов с (CH3)3SnHal (Hal = Cl, Br) образует оксо-ниевые соли [(CH3)3Sn]3O+X- ; (Ar3Sn)2O-твердые нерастворимые в-ва. При взаимод. оксидов Sn со спиртами или фенолами образуются алкокси(арокси)диалкилолово, с орг. или неорг. к-тами или их солями-соответствующие производные, напр.:
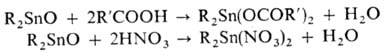
Алкоксиды-жидкости, арилоксиды-твердые в-ва, чувствительны к влаге и СО2. Р-ция гетеролитич. присоединения (C4H9)3SnOC2H5 с фенилизоцианатом используется в пром. синтезе полиуретанов:
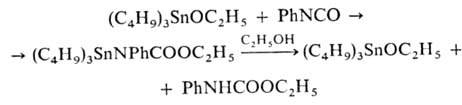
Производные неорг. к-т-обычно твердые в-ва, реже масла, орг. к-т типа RnSn(OCOR')4_n-жидкости или твердые в-ва. В р-ре эти соед. имеют мономерную структуру с внутримол. координацией, в твердом состоянии-полимерную с мостиковыми карбоксилатными группами. Производные орг. к-т при п = 3 гидролитически устойчивы, при п = 2 - частично, а при п = 1 полностью гидролизуются, при нагр. разлагаются с выделением СО2. Получают произ-, водные орг. и неорг. к-т взаимод. их солей с оловоорг. хлоридами, действием орг. к-т или их ртутных солей на R4Sn, внедрением SO3 или SO2 по связи Sn—С в R4Sn, р-цией органооловооксидов с СО2.
Органостанноновые к-ты RSn(O)OH-aмфoтcpныe неплавкие в-ва с т-рой разл. >300°С, плохо раств. в орг. р-рителях, не раств. в воде, имеют, по-видимому, полимерную структуру. С галогеноводородами образуют тригало-гениды алкилолова RSnHal3, со спиртами-соед. RSn(OR')3, с аминоспиртами образуются станнатраны, напр.:
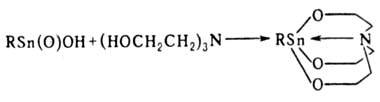
Известны 3 типа оловоорг. пероксидов: R3SnOOR', R3SnOOSnR3 и R3SnOOH. Алкоксипероксиды наиб, стабильны и охарактеризованы. Получают пероксиды замещением галогена в галогенидах Sn на пероксидную группу, напр.:
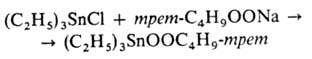
Оловоорг. гидриды RnSnH4-n (п = 1 — 3), как правило,-перегоняющиеся жидкости (СН3SnН3-газ), раств. в орг. р-рителях; мономерны; медленно разлагаются даже при комнатной т-ре, устойчивость возрастает с увеличением числа алкильных групп. Вступают в гетеролитич. и гомоли-тич. р-ции. Оловоорг. гидриды легко замещают водород при взаимод. с др. металлоорг. соед., гидридами металлов Iа гр., реактивами Гриньяра и к-тами; р-цию с Сl2СНСООН используют для их количеств, определения: R3SnH + + Сl2СНСООН 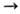 R3SnOC(O)CHCl2 + Н2. Мн. р-ции оловогидридов по кратным связям протекают гетеролити-чески, при наличии электроноакцепторных заместителей или в присут. катализаторов м. б. гомолитическими; с сопряжен ными кратными связями образуют продукты 1,4-присоеди нения, напр.:
R3SnOC(O)CHCl2 + Н2. Мн. р-ции оловогидридов по кратным связям протекают гетеролити-чески, при наличии электроноакцепторных заместителей или в присут. катализаторов м. б. гомолитическими; с сопряжен ными кратными связями образуют продукты 1,4-присоеди нения, напр.:
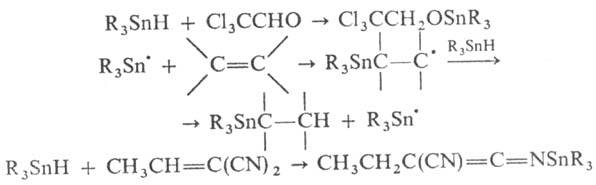
Получают R4SnH4_n восстановлением галогенидов Sn LiAlH4 или SiH4.
Оловоорганические соединения со связью Sn — N. Известны 3 типа соед.: ами-ностаннаны RnSn(NR'2)4_n, станниламины (R3Sn)nNR'3-n, станназаны (R2Sn=NR')n- Соед. [(CH3)3Sn]3N имеет плоскую структуру, [(СН3)2Sn=НС2Н5]3-циклич. тример.
Аминостаннаны вступают в р-ции присоединения и заме щения, реагируют с СН-кислотами, напр.:
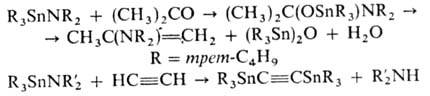
С аминами происходит трансаминирование с образованием станниламинов: (CH3)3SnN(CH3)2 + C2H5NH2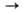
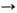 [(CH3)3Sn]2N(C2H5)2. Получают аминостаннаны нуклеоф. замещением галогена в оловогалогенидах или присоединением оловоорганических соединений со связью Sn—Х(Х = Н, OR, OSnR3, NR2) по связи C=N, напр.:
[(CH3)3Sn]2N(C2H5)2. Получают аминостаннаны нуклеоф. замещением галогена в оловогалогенидах или присоединением оловоорганических соединений со связью Sn—Х(Х = Н, OR, OSnR3, NR2) по связи C=N, напр.:
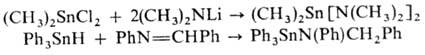
Оловоорганические соединения со связью Sn — Sn. Низшие алифатич. гекса-алкилдистаннаны R3SnSnR3-6eсцв. перегоняющиеся жидкости, устойчивые в отсутствие О2; высшие алифатич. и ароматич. соед.-твердые высокоплавкие в-ва. Известны циклич. олигомерные полистаннаны (R2Sn)n; мономерные диорганостанилены R2Sn существуют лишь как интерме-диаты.
Связь Sn—Sn в R3SnSnR3 легко расщепляется галогенами, S, О2, галогенидами Ng и Bi, щелочными металлами и их амидами, нек-рыми орг. галогенидами. Во всех случаях образуются соответствующие производные типа R3SnY (Y = галоген, металл) или (R3Sn)2Z (Z = O,S). Циклич. полистаннаны реагируют с размыканием цикла, напр. (R2Sn)4 +I2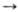 R2SnI2 , где R = трет-С4Н9. При облучении и в присут. инициаторов происходит гомолиз связи Sn—Sn с образованием радикалов R3Sn* или Ar3Sn* ; последние стабильны при обычных т-рах и находятся в равновесии с Ar3SnSnAr3. Оловоорг. радикалы - интермедиаты мн. гомо-литич. р-ций оловоорганических соединений.
R2SnI2 , где R = трет-С4Н9. При облучении и в присут. инициаторов происходит гомолиз связи Sn—Sn с образованием радикалов R3Sn* или Ar3Sn* ; последние стабильны при обычных т-рах и находятся в равновесии с Ar3SnSnAr3. Оловоорг. радикалы - интермедиаты мн. гомо-литич. р-ций оловоорганических соединений.
Гексаалкил- и гексаарилдистаннаны получают из соответствующих галогенидов, напр.: 2R3SnBr + Na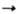 R3SnSnR3; Ph3SnBr + Ph3SnLi
R3SnSnR3; Ph3SnBr + Ph3SnLi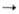 Ph3SnSnPh3; циклич. (R2Sn)n -действием оснований на R2SnH2.
Ph3SnSnPh3; циклич. (R2Sn)n -действием оснований на R2SnH2.
Оловоорганические соединения со связями Sn —S, Sn — Se, Sn — Те. Наиб. изучены сульфиды типов (R2SnS)n, (R3Sn)2S, R3SnSR', R2Sn(SR')2, RSn(SR')3.
Соед. (R2SnS)n-обычно твердые в-ва с четкими т-рами плавления, имеют структуру ди- и тримеров с 4-координац. Sn. Известны также трисульфиды (RSnS)2S-нерастворимые в-ва, при высокой т-ре разлагаются не плавясь. Сульфиды Sn по св-вам сходны с соответствующими оксидами, хотя и менее реакционноспособны: труднее гидролизуются в нейтральной среде, не присоединяются к кратным связям. Оловоорганические соединения со связями Sn—Se, Sn—Те менее изучены.
Получают сульфиды, селениды и теллуриды взаимод. оловогалогенидов с соответствующими производными щелочных металлов или внедрением S или Те по связям Sn—Sn
или Sn—Li, напр.: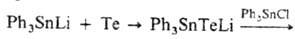
Соединения Sn(II). В этих соед. атом Sn имеет sp2-гибридизацию. Известны соед. типа R2Sn [R - циклопентадме-нил(Ср), [(CH3)3Si]2CH и др.]. Соед. Ср2Sn-бесцв. кристаллы, т. пл. 105°С, две гибридные орбнтали атома Sn служат для образования p-связи с циклопентадиеновым кольцом, на третьей орбитали находится неподеленная пара электронов. Соед. [(CH3)3Si]2CHSnCH [Si(CH3)3]2 -красные кристаллы, т. пл. 137°С, в р-ре - мономер, в твердом виде-димер, связь Sn—Sn носит частично двоесвязан-ный характер. Известно также соед. CpSnCl, бесцв. кристаллы, т. пл. 160°С, имеет структуру с мостиковыми атомами С1.
Соед. R2Sn (R = Alk)-сильные восстановители (окисляются О2 воздуха до оксидов Alk2SnO, выделяют Ag из AgNO3 и Hg из сулемы), при нагр. выделяют металлич. Sn и переходят в оловоорганические соединения Sn(IV); Cp2Sn при действии НХ (X = OR', CN и др.) образует SnX2, с SnCl2 при облучении дает CpSnCl, с СН3I-соед. Sn(IV) CH3Cp2SnI.
Оловоорганические соединения Sn(II) получают при действии металлоорг. соед. на SnCl2, напр. 2RLi + SnCl2 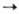 R2Sn + 2LiCl (R = Cp и др.) или при фотолизе (R2Sn)n. Оловодиалкилы м. б. получены дегалогенированием R,SnCl2 Zn, амальгамой Na или Na в жидком NH3, напр.(С2Н5)2SnСl2+ Zn
R2Sn + 2LiCl (R = Cp и др.) или при фотолизе (R2Sn)n. Оловодиалкилы м. б. получены дегалогенированием R,SnCl2 Zn, амальгамой Na или Na в жидком NH3, напр.(С2Н5)2SnСl2+ Zn 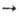 (C2H5),Sn + + ZnCl2.
(C2H5),Sn + + ZnCl2.
Применение. Оловоорганические соединения применяют в пром-сти и с. х-вс. Так, дибутилоловодилаурат - стабилизатор ПВХ, катализатор в произ-ве полиуретановых пен; (C4H9)3SnOONa -гидрофобизирующий агент для целлюлозы, хлопкового текстиля, бумаги, дерева; [(C4H0),Sn]2O, Ph,SnOCOCH3 и [(C4H9)3SnO]3PO-фунгициды, (цикло-С6Н11)SnOH (цигек-сатин)-акарицид, (C4H9)3SnX и Ph3SnX (X = F, ОСОСН3 и др.)-биоцидные компоненты противообрастающих красок.
Тетраалкилолово, а также гидриды, алкоксиды, амиды Sn и др. применяют в орг. синтезе.
Оловоорганические соединения, особенно производные триалкилолова R3SnX, высокотоксичны, токсичность оловоорганических соединений R2SnX, значительно ниже.
Мировой объем ироиз-ва оловоорганических соединений 35 тыс. т (1980).
Лит.: Методы элементоорганической химии. Германий, олово, свинец, под общ. ред. А. Н. Несмеянова и К. А. Кочешкова, М., 1968; Comprehensive organometallic chemistry, ed by G.Wilkinson, v. 2, N.Y.-[a.o.], 1982, p. 519-628.
A.C. Перегудов.
