§ 1. Щелочные металлы
Применяемое к элементам ряда Li–Cs название щелочные металлы связано с тем, что их гидроокиси являются сильными щелочами. Натрий и калий относятся к наиболее распространенным элементам, составляя соответственно 2,0 и 1,1% от общего числа атомов земной коры. Содержание в ней лития (0,02%), рубидия (0,004%) и цезия (0,00009) уже значительно меньше, а франция – ничтожно мало.
В природе щелочные металлы встречаются исключительно в виде соединений. Натрий и калий являются постоянными составными частями многих весьма распространенных силикатов. Из отдельных минералов натрия важнейший–поваренная соль (NaCl) –входит в состав морской воды и на отдельных участках земной поверхности образует под слоем наносных пород громадные залежи так называемой каменной соли (в СССР – Соликамск, Артемовен, Илецк и т. д.). В верхних слоях подобных залежей иногда содержатся и скопления солей калия [в виде минералов сильвинита (KCl–NaCl), карналлита (KCl·MgCl2 ·6Н2 О) и др.], служащие основным источником получения соединений этого элемента. Имеющих промышленное значение природных скоплений калийных солей известно лишь немного. Важнейшим из них является Соликамское месторождение в СССР.
Для лития известен ряд минералов [например, сподумен – LiAl (SiO3 ) 2 ], но скопления их редки. Рубидий и цезий встречаются почти исключительно в виде примесей к другим щелочным металлам. Следы франция всегда содержатся з урановых рудах.
Соединения натрия и калия имеют огромное значение для жизни. Достаточно напомнить хотя бы то, что человек потребляет ежегодно 5–10 кг NaCl Подобным же образом для растений необходимы соли калия. В связи с этим около 90% всех добываемых калийных соединений употребляются для удобрения почв. Остальные 10%, равно как и громадные количества различных соединений натрия, используются в промышленности. Лишь сравнительно небольшое по объему применение находят пока производные лития и весьма ограниченное –соединения Rb и Cs.
В свободном состоянии щелочные металлы могут быть выделены электролизом их расплавленных хлористых солей. Основное практическое значение имеет натрий, ежегодная мировая выработка которого составляет более 50 тыс. т.
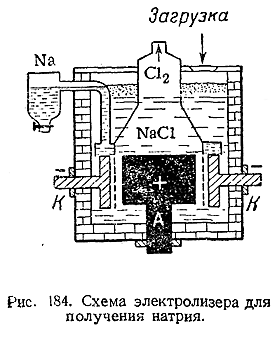
1) Схема установки для получения металлического натрия электролизом расплавленного NaCl показана на рис. 184. Сама ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом обычно служит не чистый NaCl (т. пл. 800 °С), а более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl.
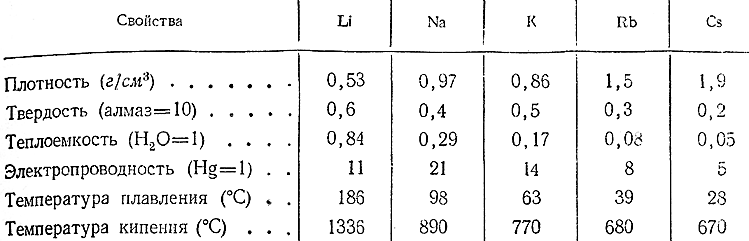
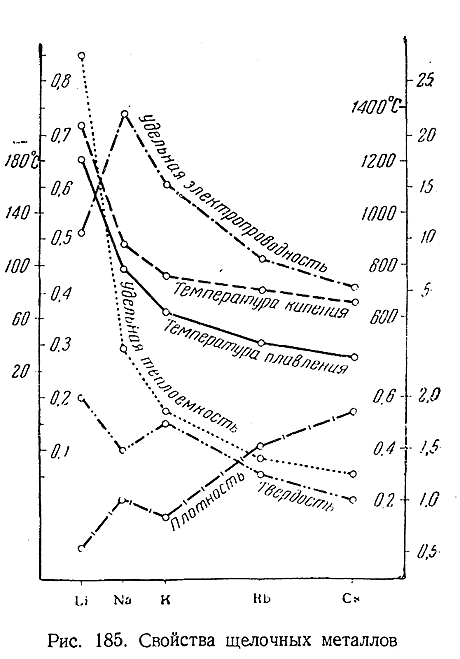
В отсутствие воздуха литий и его аналоги представляют собой серебристо–белые вещества с металлическим блеском. Все щелочные металлы характеризуются небольшими – удельными весами, малой твердостью, низкими температурами плавления и кипения и хорошей электропроводностью. Их важнейшие константы сопоставлены в приводимой таблице. Ход изменения констант по ряду Li–Cs виден из Рис. 185.
Благодаря малой плотности Li, Na и К всплывают на воде (Li–даже на керосине). Щелочные металлы легко режутся ножом, а наиболее мягкий из них – цезий по твердости не превышает воск.
Все они растворимы в ртути (хуже других – литий). Несветящееся пламя газовой горелки щелочные металлы и их летучие соединения окрашивают в характерные цвета: Li – в карминово–красный, Na – в ярко–желтый, К, Rb и Cs – в розово–фиолетовый.
Литий и его аналоги являются исключительно реакционноспособными металлами (причем активность их по направлению от Li к Cs обычно возрастает). Во всех своих соединениях щелочные металлы одновалентны. Располагаясь в крайней левой части ряда напряжений, они энергично взаимодействуют с водой по схеме:
2Э +2Н2О = 2ЭОН + Н2
В процессе реакции с Li и Na выделение водорода не сопровождается его воспламенением, с К оно уже происходит, а с Rb и Cs взаимодействие протекает со взрывом.
В соприкосновении с воздухом свежие разрезы Na и К (в меньшей степени и Li) тотчас покрываются рыхлой пленкой продуктов окисления. Ввиду этого Na и К хранят обычно под керосином.
При нагревании Na и К на воздухе они легко загораются, а рубидий и цезий самовоспламеняются уже при обычной температуре.
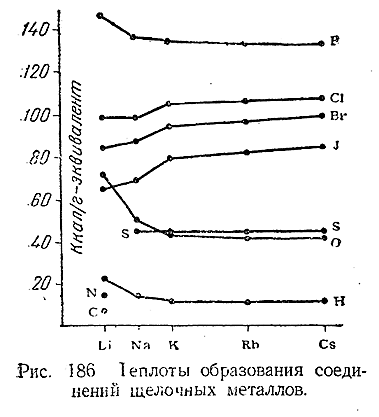
При наличии следов влаги щелочные металлы воспламеняются в атмосфере хлора. Взаимодействие Cs, Rb и К с жидким бромом сопровождается сильным взрывом, тогда как Na и Li при обычных температурах реагируют только поверхностно. С иодом реакции протекают энергична лишь при подогревании. Во всех случаях взаимодействия с галоидами продуктом реакции являет ся соответствующая соль (ЭГ) Образование сульфида (Э2 S) при растирании щелочного металла с порошком, серы сопровождается взрывом. При нагревании в атмосфере водорода литий и его аналоги образуют гидриды (ЭН), имеющие характер типичных солей, в которых отрицательным ионом является водород (Н–). С азотом и углеродом непосредственно соединяется только литий. Образование его нитрида (Li3 N) медленно идет в атмосфере азота уже при обычны температурах. Напротив, карбид лития (Li2 C2 ) может быть получен из элементов лишь при нагревании. Теплоты образована соединений щелочных металлов сопоставлены на рис. 186.
2) По внешнему виду и большинству физических свойств гидриды щелочных металлов похожи на соответствующие галоидные соли. Так, лучше других изученный LiH образует твердые бесцветные кристаллы (типа NaCl), в отсутствие воздуха плавящиеся без разложения при 680 °С.
Солеобразная природа рассматриваемых гидридов была также непосредственно доказана выделением водорода при электролизе расплавленного LiH на аноде.
Гидриды щелочных металлов являются сильными восстановителями, а при взаимодействии их с водой происходит бурная реакция по схеме:
ЭН + Н2О = Н2 + ЭОН
или в ионах:
Н– + Н+ = Н2
При сгорании щелочных металлов в избытке кислорода образуются соединения следующего состава:
Li2 O – белый
Na2 O2 – белый
KO2 – желтый
RbO2 – желтый
CsO2 – желтый
Из всех этих веществ нормальным окислом является только Li2O, а остальные представляют собой .перекиси ые соединения.
Практическое применение находит главным образом перекись натрия (Na2 O2 ). Получают ее сжиганием металлического натрия в алюминиевых сосудах:
2Na + О2 = Na2 O2
Образующийся продукт обычно представляет собой порошок или крупинки желтоватого цвета.
Взаимодействие Na2 O2 с водой сопровождается гидролизом:
Na2 O2 + 2Н2 О < = >2NaOH + Н2 О2
На выделении Н2 О2 при этой реакции основано использование перекиси натрия для отбелки различных материалов. Взаимодействие Na2 O2 с углекислым газом по схеме
2Na2O2 + 2СО2 = 2Na2CO3 + O2
служит основой применения перекиси натрия как источника кислорода в изолирующих противогазах и на подводных лодках. С легко окисляющимися веществами перекись натрия реагирует настолько энергично, что взрыв может иногда последовать уже при простом соприкосновении.
3) Чистая или содержащая различные добавки (например, хлорной извести с примесью солей Ni или Cu) перекись натрия носит техническое название оксилит. Смешанные препараты оксилита особенно удобны для получения кислорода, который выделяется при взаимодействии с водой.
4) Перекиси К, Rb и Cs типа ЭО2 представляют собой твердые вещества, плавящиеся около 400 °С. Все они расплываются на воздухе и являются чрезвычайно энергичными окислителями.
Взаимодействие их с разбавленными кислотами идет по схеме:
2ЭO2 + H2 SO4 = Э2 SO4 + H2 O2 + O2
Решетка кристалла перекиси ЭО2 подобна решетке СаС2 (рис. 138), т. е. образована ионами Э+ и О2 . Перекись калия (КО2 ) нередко вводится в состав ксилита. Взаимодействие последнего с углекислотой в этом случае идет по суммарному уравнению
Na2 O2 + 2KO2 + 2CO2 = Na2 CO3 + K2CO3 + 2O2
т. е. углекислый газ заменяется равным объемом кислорода.
Нормальные окислы щелочных металлов (за исключением Li2 O) могут быть получены только косвенным путем. Все они представляют собой твердые вещества следующих цветов:
Li2 O – белый
Na2 O – белый
K2 O – белый
Rb2 O – желтый
Cs2 O – оранжевый
Окись лития гидратируется сравнительно медленно. Напротив, окислы остальных щелочных металлов реагируют с водой весьма энергично. Взаимодействие протекает по схеме
Э2 О + Н2 О = 2ЭOН
и сопровождается большим выделением тепла. Непосредственного применения окислы щелочных металлов пока не находят.
Гидроокиси (ЭОН) щелочных металлов представляют собой бесцветные очень гигроскопичные вещества, разъедающие большиинство соприкасающихся с ними материалов. Отсюда их часто употребляемое в практике название — едкие щелочи.
В воде (и спирте) гидроокиси щелочных металлов хорошо растворимы. Так как они диссоциируют на ионы в большей степени, чем гидроокиси всех других металлов, едкие щелочи являются самыми сильными основаниями.
5) Ниже сопоставлены свойства гидроокисей щелочных металлов:

В противоположность гидроокисям остальных металлов NaOH и его аналоги не отшепляюг воду даже при нагревании до своих температур кипения (NaOH — 1388 °С, КОН—1324 °С).
Исключение представляет LiOH, который начинает терять воду уже около 600 °С. Так как в расплавленном состоянии едкие щелочи сильно разъедают стеклянную, фарфоровую и (при доступе воздуха) платиновую посуду, для их плавления пользуются сосудами из серебра, никеля или железа.
6) Под действием едких щелочей кожа человечского тела сильно разбухает, становится скользкой; в дальнейшем образуется очень болезненный глубокий ожог. Попавшую на руки или платье щелочь следует тотчас же смыть водой, затем смочить пораженное место очень разбавленным раствором какой–либо кислоты и вновь промыть водой. Ткани из волокон животного происхождения быстро разрушаются от действия щелочей, тогда как растительные волокна по отношению к ним довольно устойчивы (наоборот, кислоты быстрее разъедают волокна растительного происхождения, чем животного).
Гидроокись натрия (иначе, едкий натр, каустическая сода) потребляется самыми разнообразными отраслями промышленности. Ее ежегодная мировая выработка составляет несколько миллионов тонн, причем большая часть добывается электролизом растворов NaCl. Реже пользуются в настоящее время обменным разложениехМ соды с гашеной известью:
Na2 CO3 + Са(ОН)2 = СаСО3 + 2NaOH
Выработка NaOH в СССР составила в 1962 г. 961 тыс. т (против 190 тыс. т в 1940 г. и 55 тыс. т в 1913 г.). Из гидратов окисей других щелочных металлов значительное практическое применение находит только КОН (едкое кали). Вырабатывают его обычным электролизом растворов КСl.
7) Электролиз растворов NaCl (и КСl) является одним из основных процессов химической промышленности, так как ведет к одновременному получению двух весьма важных для техники веществ – едкой щелочи и свободного хлора (ср. VII § 2). В качестве побочного продукта получается также водород.
Важнейшим условием правильной работы электролитической установки является отсутствие взаимодействия между образующимися продуктами (щелочью й хлором), что может быть достигнуто максимальным затруднением смешивания анодной и катодной жидкостей. При особенно часто применяемом диафpaгменном методе (см. рис. 96) анодное и катодное пространства отделяются друг от друга диафрагмой из хорошо проницаемого для жидкостей асбестового картона. Анод изготовляется из графита, катод – из железа. В процессе электролиза раствор щелочного хлорида непрерывно подается в анодное пространство, а из катодного непрерывно вытекает раствор смеси щелочного хлорида и щелочи. При его упаривании хлорид выкристаллизовывается. Полученный раствор NaOH выпаривается в железных чанах, после чего сухой остаток переплавляют.
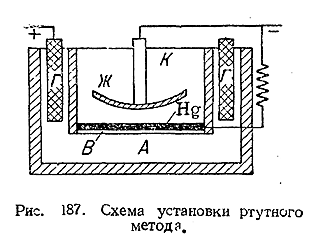
8) Примером установки для электролиза раствора NaCl по так называемому ртутному методу может служить ванна, схематически показанная на рис. 187. Катодное пространство (К) в ней совершенно отделено от анодного (А) глухими боковыми перегородками и слоем ртути, лежащим на тон кой пластине из мелкопористого материала (3), Анодом служат графитовые электроды (Г), катодом–сам слой ртути и вспомогательный железный электрод (Ж). При электролизе находящегося в анодном пространстве раствора NaCl хлор выделяется у анодов (Г), а катионы разряжаются на ртути, причем получается амальгама натрия. Так как последняя имеет меньшую плотность, чем сама ртуть, она всплывает на поверхность слоя и взаимодействует с заполняющей катодное пространство водой с образованием едкой щелочи и выделением водорода (у электрода Ж). Получаемая по этому способу щелочь отличается большой чистотой.
Ионы щелочных металлов бесцветны. Почти все соли, образуемые ими с обычными кислотами, хорошо растворимы в воде. В противоположность выделяющимся обычно без кристаллизационной воды солям К, Rb и Cs для солей лития весьма характерно образование кристаллогидратов. Натрий занимает промежуточное положение. Соли щелочных металлов и слабых кислот вследствие гидролиза показывают в растворе щелочную реакцию. Комплексные соединения с ионом щелочного металла в качестве комплексообразователя известны лишь для лития. Напротив, весьма обычны комплексные производные, у которых ионы щелочного металла располагаются во внешней сфере. Многие из подобных комплексов отличаются устойчивостью, возрастающей по ряду Li–Cs.
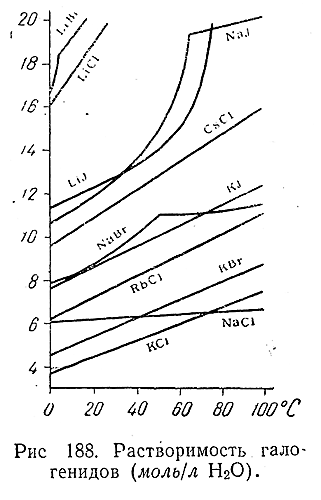
Галоидные соли рассматриваемых элементов представляют собой довольно тугоплавкие кристаллические вещества, за исключением LiF (и отчасти NaF), хорошо растворимые в воде (Рис. 188). Наибольшее практическое значение из них имеет NaCl. Помимо потребления с пищей (отсюда название – поваренная соль) громадные количества хлористого натрия используются промышленностью. Его ежегодное мировое потребление исчисляется десятками миллионов тонн.
Источниками промышленного получения NaCl служат, с одной стороны, природные залежи каменной соли, с другой — моря и соленые озера (в СССР — Баскунчак и др.). Из залежей каменной соли последняя просто выламывается и затем измельчается. Такая соль часто бывает настолько чиста, что не требует дальнейшей очистки. Из морей и соленых озер NaCl добывают упарванием рассолов под действием солнца или вымораживанием воды. Получаемая таким путем соль часто бывает загрязнена примесями (главным образом ионов Са2+ , Mg2+ и SO4 2–) и во влажном воздухе отсыревает. Напротив, вполне чистая поваренная соль негигроскопична. Из других галогенидов щелочных металлов громадное значение имеет КCl — основа калийных удобрений.
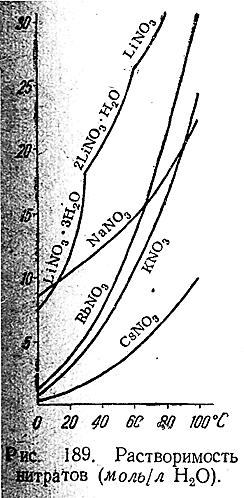
Нитраты щелочных металлов сравнительно легкоплавки и хорошо растворимы в воде (рис. 189). Практическое значение из них имеют почти исключительно NaNO3 и KNO3 . Обе соли используются главным образом в качестве минеральных удобрений. Первую из них получают обычно как побочный продукт азотнокислотного производства (за счет поглощения щелочами окислов азота из отходящих газов), а вторую — обменным разложением КСl и NaNО3.
Ввиду двухосновности угольной кислоты она со щелочными металлами образует соли двух типов — кислые (ЭНСО3 ) и средние (Э2 СО3 ). Кислые карбонаты (бикарбонаты) известны для всех щелочных металлов кроме Li. Из растворов они выделяются без кристаллизационной воды. При нагревании бикарбонаты довольно легко переходят в средние соли угольной кислоты:
2ЭHСО3 = Э2 СО3 + СО2 + Н2 О
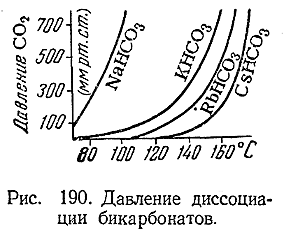
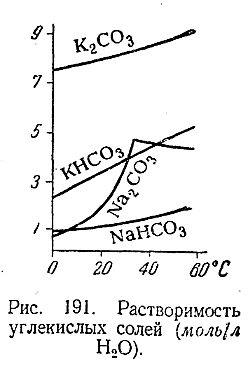
По ряду Na—Cs их термическая устойчивость возрастает (рис. 190).
За исключением МаНСОз, рассматриваемые бикарбонаты хорошо растворимы. Вследствие гидролиза растворы их показывают очень слабощелочную реакцию. При нагревании этих растворов из них частично выделяется СО2 (в соответствии с приводившимися выше уравнением распада), и реакция становится сильнощелочной. В соприкосновении с воздухом такое выделение СО2 растворами бикарбонатов очень медленно происходит и при обычной температуре. Практическое применение находит главным образом NaHCO3 («питьевая сода»), используемый в медицине, кондитерской промышленности и т. д.
Нормальные карбонаты щелочных металлов, за исключением Li2 CO3 , хорошо растворимы в воде (рис. 191), причем в результате гидролиза растворы их показывают сильнощелочную реакцию. Наибольшее значение имеет сода (Na2 CO3 ). Вырабатывается она или в безводном состоянии. («кальцинированнаясода») или в виде выветривающегося на воздухе кристаллогидрата Na2 CO3 ·10H2 O («кристаллическая сода»).
Потребителями соды являются многие отрасли промышленности. Кроме того, она применяется при стирке белья и т. д. Выработка кальцинированной соды по СССР составила в 1962 г. 2,3 млн. т (против 536 тыс. т в 1940 г. и 160 тыс. т в 1913 г.). В значительных количествах потребляется промышленностью (преимущественно – стекольной) также поташ – К2 СО3 .
Основное значение для производства соды имеет аммиачный метод, основанный на реакции
NaCl + NH4 HCO3 = NaНСО3 + NH4 Cl
Равновесие которой ввиду сравнительно малой растворимости NaHCO3 смещено вправо. Концентрированный раствор NaCl сперва насыщают аммиаком, а затем обрабатывают углекислым газом (получаемым за счет обжига СаСО3 ). Выделяющийся NaHCO3 отфильтровывают и нагрезанием дереводят в Na2 СОз, причем образующийся углекислый газ возвращают в производство. Содержащий NH4 Cl маточный раствор обрабатывают гашеной известью и выделяющийся при этом аммиак также возвращают в производство. Таким образом, единственным отходом является остающийся в растворе СаСl2 .
9) Принципиальная схема заводской установки для получения соды по аммиачному методу показана на рис. 192. В печи (А) идет обжиг известняка, при чем образующийся углекислый газ поступает в карбонизационную башню (Б), а СаО гасится водой (В), после чего Са(ОН)2 перекачивается в смеситель (Г)где встречается с NH4 Cl и выделяет из него аммиак. Последний поступает в абсорбер (Д) и насышает там крепкий раствор NaCl, который затем перекачивается в карбонизационную башню, где и взаимодействует с СО2 , образуя NaHCO3 и NH4 Cl. Из обеих этих солей первая задерживается на вакуумфильтре (Е), а вторая вновь перекачивается в смеситель (Г). Таким образом все время расходуются NaCl и известняк, а получаются NaHCO3 и СаСl2 (последний – в виде отброса производства). Бикарбонат натрия переводят затем нагреванием в соду.
10) При наличии природных источников Na2 SO4 рентабельным может быть и более старый, сульфатный способ производства соды. Последний осуществляется путем сплавления при 1000 °С смеси Na2 SO4 , известняка и угля. При этом протекает реакция:
Na2 SO4 + 2C + CaCO3 = 2СО2 + Na2 CO3 + CaS
От труднорастворимого CaS соду отделяют путем обработки сплава водой. Отход производства –CaS – может служить исходным продуктом для получения из него H2 S и затем серы.
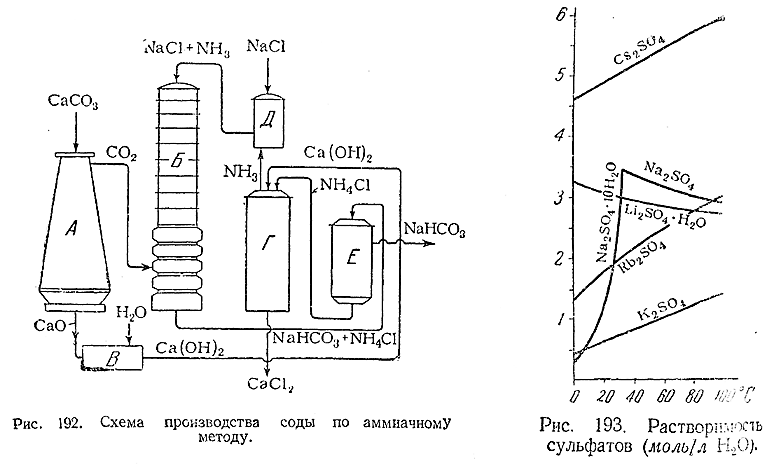
Подобно карбонатам, сульфаты щелочных металлов тоже известны кислые (ЭHSO4 ) и средние (Э2 SO4 ). В воде и те и другие хорошо растворимы (рис. 193). Практическое значение имеют главным образом Na2 SO4 (в технике часто называемый просто сульфат) и K2 SO4 , особенно первый из них. Важнейшим их потребителем является стекольная промышленность. Кристаллогидрат Na2 SO4 ·10H2 O («мирабилит», или «глауберова соль») применяется в медицине как слабительное.
Промышленное получение Na2 SO4 и K2 SO4 основано либо на их выделении из природных минералов, либо на обработке соответствующих хлоридов серной кислотой. В последнем случае сульфаты являются побочными продуктами производства соляной кис–лоты. Громадные количества мирабилита содержат воды Кара–Богаз–Гола.
Из сопоставления свойств щелочных металлов и их соединений видно, что по ряду Li–Cs они в общем изменяются весьма закономерно. Подобно тому как это наблюдалось у В и Be, первый элемент подгруппы–литий занимает несколько особое положение. Малая растворимость его солей с анионами CO3 2–, PO4 3–и F–, а также гидроокиси, сравнительная легкость отщепления от последней воды при нагревании и некоторые другие свойства приближают литий к магнию и кальцию. Однако в основном литий все же является типичным щелочным металлом.


