§ 1. Семейство железа
На долю железа приходится около 1,5% от общего числа атомов земной коры. Содержание в последней кобальта (0,001 %) и никеля (0,003%) уже несравненно меньше.
Большая часть железа верхних слоев земли находится в виде кислородных соединений, из которых наиболее важны промышленные руды этого металла – бурый железняк [Fe2 O3 ·2Fe(ОН)3 ], красный железняк (Fe2 O3 ) и магнитный железняк (FeO·Fe2 O3 ). Значительные количества железа встречаются в виде минерала сидерита (FeCO3 ), а также в соединениях с серой и мышьяком. Для кобальта и никеля наиболее характерно совместное нахождение с последними двумя элементами. Примерами их минералов могут служить пентландит (FeS·NiS) и кобальтин (CoAsS). Богатейшие железорудные месторождения имеются в ряде районов России (Урал, Кривой Рог, Керчь, Курск и др.).
Из элементов семейства Fe совершенно исключительное значение имеет само железо, являющееся основой всей современной техники. Для характеристики его особой роли достаточно указать на то, что ежегодное мировое потребление железа составляет более 200 млн. т.
Гораздо меньше потребление никеля и еще меньше — кобальта. Оба последних элемента используются главным образом в составе различных сплавов с другими металлами.
1) При добыче никеля и кобальта из их природных руд большие трудности представляет отделение этих элементов как от других одновременно содержащихся в руде металлов, так и друг от друга. Поэтому весь процесс весьма сложен и, кроме того, меняется в зависимости от характера руды. Ежегодная мировая выплавка никеля составляет около 250 тыс. т, кобальта — около 15 тыс. г.
Выплавка железа из руд производится в специальных вертикальных печах высотой 25 и более метров, со стальной внешней оболочкой и внутренней обкладкой из огнеупорного кирпича. Печи эти носят название доменных («домны»). Производительность их достигает 2 тыс. т металла за сутки.
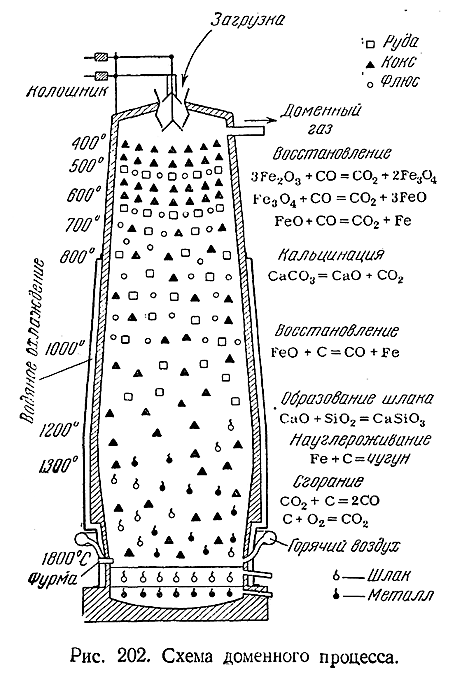
По характеру своей работы домна (рис. 202) является печью непрерывного действия. Будучи раз введена в эксплуатацию («задута»), она затем безостановочно функционирует в течение нескольких лет, Для поддержания процесса, сводящегося, в основном, к восстановлению железа из его окислов, сверху через колошник вводится «шихта», т. е. последовательные слои железной руды, кокса и т. н. флюсов – специальных добавок (чаще всего СаСО3 ), необходимых для придания легкоплавкости образующемуся шлаку. Снизу через фурмы в домну все время вдувается воздух, предварительно нагретый до 600–800°С. За счет сгорания кокса температура в нижней части домны поддерживается на уровне приблизительно 1800°С. По направлению кверху она постепенно понижается и у колошника равна около 400°С. Накапливающиеся на дне печи расплавленный металл и жидкий шлак периодически выпускаются через специальные отверстия. Последовательный ход доменного процесса виден из рис. 202.
2) На каждую тысячу тонн выплавляемого металла при доменном процессе расходуется около 2 тыс. т. железной руды, 1 тыс. т. кокса, 400 т известняка и 3 тыс. т воздуха. Помимо 1 тыс. т металла, получается около 500 г шлака л 5 тыс. т доменного газа.
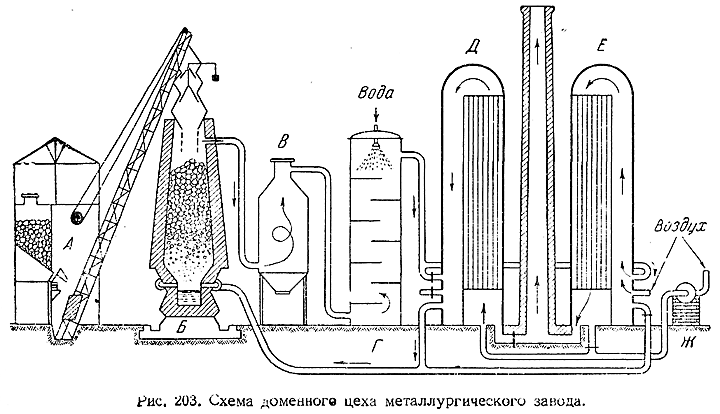
3) Выходящие из домны газы содержат приблизительно 30% окиси углерода и имеют теплотворную способность около 1000 ккал/м3. Они используются главным образом путем сжигания в кауперах для подогрева поступающего в Фурмы воздуха. Перед этим их обычно освобождают от пыли (в специальных камерах) и примесей органических веществ (промывкой водой в скрубберах).
4) В состав доменных шлаков входят главным образом CaO, SiO2 и Аl2 О3 . Шлаки эти часто используются для изготовления цемента (т. н. шлаковый цемент), бетона и искусственных камней. Иногда они химически связывают содержащиеся в исходной железной руде ценные примеси. Например, шлаки от выплазки керченских руд служат хорошим сырьем для получения ванадия и его соединений.
5) Схема доменного цеха металлургического завода показана на рис. 203. При помощи механизированного загрузочного устройства (Л) домна (Б) периодически снабжается свежими порциями шихты. Образующиеся при процессе газы, пройдя через пылевую камеру (В) и скруббер (Г), сгорают в каупере (Е), накаливая внутреннюю обкладку последнего. Параллельно через предварительнонакаленный подобным же образом другой каупер (Д) воздуходувка (Ж) гони? воздух в фурмы доменной печи. Через некоторое время роли кауперов Е и Д меняют: первый становится охлаждающимся, второй нагреваемым. Каждую домну обычно обслуживает несколько кауперов.
6) При пользовании для дутья воздухом, содержащим повышенный (против обычного) процент кислорода, предварительный подогрев его становится излишним и кауперы могут быть упразднены. Вместе с тем кислородное дутье значительно повышает производительность домны и улучшает качество побочных продуктов производства – газа и шлака. В частности, получаемые при этих условиях газы, помимо увеличения их калорийности (за счет газификации кокса), становятся пригодными для использования при различных каталитических синтезах. Таким образом, сама домна превращается в комплексный агрегат, одновременно вырабатывающий полупродукты для металлургической (чугун), химической (газ) и строительной (шлак) промышленности.
Получающийся при доменном процессе металл представляет собой сплав железа с углеродом, содержащий и другие примеси, чаще всего Si, P, Мn и S. Присутствие всех этих элементов сильно влияет на механические свойства металла. Особенно велика роль углерода. При содержании последнего более 1,7% получается чугун, который и является конечным продуктом доменного процесса. Выплавка чугуна по СССР составила в 1962 г. 55,3 млн. г (против 14,9 млн. т в 1940 г. и 4,2 млн. г в 1913 г.).
Интервал 1,7–0,2% С отвечает различным сортам стала, а металл с еще меньшим содержанием углерода носит название ковкого железа. Чугун тверд, но хрупок и, как правило, не поддается ковке или прокатке. Он идет главным образом для отливок различных тяжелых машинных частей (станин и т. п.). Сталь очень тверда и вместе с тем эластична. Поэтому она применяется для изготовления всех конструкций и отдельных деталей, от которых требуется особая прочность. Ковкое железо отличается своей мягкостью. Из него готовят кровельное железо, проволоку, гвозди и т. д.
Для понижения содержания углерода в получаемом при доменном процессе чугуне к последнему обычно добавляют окислы железа и выдерживают его при высокой температуре в токе воздуха. При этом происходит выгорание углерода (а также большинства остальных примесей) и в результате образуется сталь или ковкое железо. Вводя в обычную углеродистую сталь примеси других элементов, получают различные сорта специальных сталей, удовлетворяющие самым разнообразным запросам машиностроения.
Обычно выплавка стали превышает выработку чугуна, что обусловлено переплавкой на сталь большого количества железного лома. Выплавка стали по СССР составила в 1962 г. 76,3 млн. т (против 18,3 млн. г в 1940 г. и 4,2 млн. т в 1913 г.).
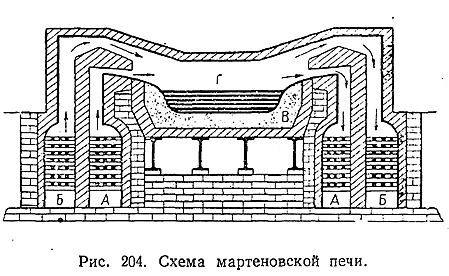
7) Температура затвердевания доменного чугуна обычно лежит около 1200 °С (причем переход из жидкого в твердое состояние сопровождается увеличением объема). Для переработки его на сталь (или ковкое железо) основное значение имеет мартеновский процесс, основанный на использовании так называемой регенеративной печи. Принцип метода заключается в выжигании из доменного чугуна примесей за счет кислорода воздуха, проходящего над расплавленным металлом, и кислорода добавляемых к нему окислов железа (в виде ржавого железного лома или чистой железной руды). Необходимая для поддержания металла з жидком состоянии высокая температура достигается сжиганием над ним смеси горючего газа и воздуха (в избытке), предварительно сильно нагретых за счет тепла отходящих газов. Конструктивно это предварительное нагревание осуществляется в мартеновской печи путем периодического изменения направления потока газов на обратный. Пусть, как показано на рис. 204 стрелками, горючий газ (А) и воздух (Б) входят первоначально слева. Смешиваясь у начала пространства над расплавленым металлом (Г), они сгорают, причем отходящие газы нагревают камеры А и Б правой части печи. После того как эти камеры достаточно накалятся, ток газа и воздуха меняют на обратный. Теперь правые камеры отдают им свое тепло, а левые накаливаются отходящими газами и т. д. При пользовании для нагревания мартеновской печи сжиганием нефти (вбрызгиваемой прямо в пространство над металлом) камеры А становятся излишними.
Довольно большая продолжительность мартеновского процесса (несколько часов) позволяет легко управлять им с целью получения металла желательного состава. В зависимости от характера исходных чугунов, футеровка пода мартеновской печи (В, рис. 204) делается «кислой» (из силикатных материалов) или «основной» (из жженого доломита). Большие возможности интенсификации этого процесса открывает использование воздуха, предварительно обогащенного кислородом.
8) Введение в обычную углеродистую сталь различных примесей существенно влияет на ее свойства. Так, добавка кремния сказывается главным образом на увеличении эластичности, марганца – на увеличении вязкости, вольфрама – на увеличении твердости и т. д. Комбинируя подобные «присадки» в подходящих соотношениях, можно получать специальные стали с самыми разнообразными свойствами.
9) Некоторые сорта стали содержат большое количество никеля. Например, обычная нержавеющая сталь содержит около 18% Сr и 9% Ni.
10) Кобальт чаще всего применяется в виде сплавов, служащих для изготовления наконечников резцов, сверл и т. п. Такие сверхтвердые сплавы («ВК», «победит» и др.) обычно представляют собой сцементированные кобальтом карбиды вольфрама. Они содержат 78–88% W, 6–15% Со, 5–6% С и особенно ценны тем, что допускают громадные скорости металлообработки, так как не теряют твердости даже при 1000° С.
В химически чистом состоянии железо, кобальт и никель могут быть получены восстановлением их окислов водородом или элекролизом растворов солей. Все три элемента представляют собой блестящие белые металлы с сероватым (Fe, Co) или серебристым (Ni) оттенком. Важнейшие их константы сопоставлены ниже:

Железо и никель легко куются и прокатываются. Кобальт более тверд и хрупок. В отличие от других металлов Fe, Co и Ni притягиваются магнитом.
По химическим свойствам железо, кобальт и никель являются металлами средней активности. В отсутствие влаги они при обычных условиях заметно не реагируют даже с такими типичными металлоидами, как О, S, Cl и Br. Однако при нагревании взаимодействие со всеми ними протекает довольно энергично, особенно если металлы находятся в измельченном состоянии.
11) Помимо перечисленных выше металлоидов, Fe, Co и Ni при нагревании способны соединяться с С, Si, P, As, Sb. В частности, для их карбидов характерен состав Э3 С Все три элемента семейства железа (особенно в мелко раздробленном состоянии и при повышенных температурах) поглощают довольно значительные количества водорода. Однако определенные химические соединения при этом не образуются.
12) При нагревании мелко раздробленных Fe, Co и Ni в атмосфере СО образуются их карбонильные соединения (X § 1). Состав последних отвечает формулам Fe(CO)5 , [Со(СО)4 ]2 и Ni(CO)4 . Легче других (уже под обычным давлением) образуется карбонил никеля, который представляет собой бесцветную жидкость (т. пл. –25 °С, т. кип. 42 °С). Его образованием и последующим термическим разложением пользуются иногда для извлечения никеля из руд.
Располагаясь в ряду напряжений между железом и оловом. Со и Ni стоят ближе к последнему. Поэтому оба металла растворяются в разбавленных кислотах значительно медленнее железа.
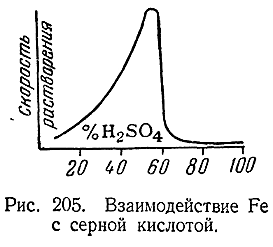
Зависимость скорости взаи модействия Fe с серной кислотой от ее концентрации показана на рис. 205. Устойчивость к действию концентрированной HNO3 по ряду Fe–Со–Ni быстро уменьшается. Cuльные щелочи на все три элемента не действуют.
По отношению к воздуху и воде кобальт, никель и химически чистое железо (в виде компактных металлов) устойчивы, тогда как содержащее примеси железо под совместным действием влаги, углекислого газа и кислорода воздуха подвергается коррозии, т. е. разъеданию с поверхности. Образующийся при этом на железных изделиях слой ржавчины состоит главным образом из водной окиси железа, по составу приблизительно отвечающей формуле Fe2O3 · H2 O. Так как слой этот хрупок и порист, он не предохраняет металл от дальнейшего ржавления. В результате коррозии железных изделий по всему миру ежегодно теряется такое количество Fe, которое отвечает приблизительно четверти его мировой добычи за то же время.
Основной реакцией процесса коррозии металлов при контакте их с водой или влажным воздухом является вытеснение водорода, в случае железа протекающее по схеме:
Fe + 2Н+ = F2++ 2Н
Помимо природы самого металла и концентрации водородных ионов, скорость процесса сильно зависит от быстроты смещения равновесия этой основной реакции вправо за счет вторичных реакций, так или иначе связывающих образующиеся продукты.
Главная роль при этом обычно принадлежит растворенному в воде кислороду (из возуха). В частности, Fe2+окисляется им до Fe3+, а атомарный водород – до Н2 О. Суммарно процесс ржавления железа может быть выражен следующим уравнением:
4Fe + 2Н2 О + 3O2 = 2(Fe2 O3 ·Н2 О)
Для уменьшения коррозионных потерь железные изделия стараются изолировать от воды и воздуха, покрывая их слоем масляной краски или какого–либо устойчивого при обычных условиях металла. В качестве такового чаще всего пользуются цинком («оцинкованное железо») или оловом («луженое железо»). Нередко применяется также никелирование – покрытие железных изделий тонким слоем никеля. Однако все эти способы защиты оказываются действительными лишь до тех пор, пока цельность покровного слоя нигде не нарушена. Применение их ведет таким образом не к полному устранению процесса ржавления, а лишь к задержке его на более или менее продолжительное время.
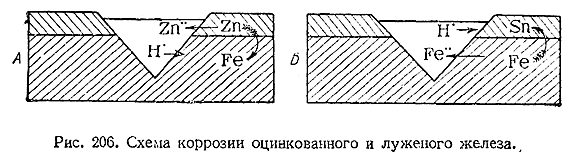
13) Если взаимодействию с влажным воздухом или водой подвергается химически чистый металл, то выделяющийся первоначально водород в большей или меньшей степени удерживается его поверхностью и предохраняет последнюю от дальнейшей коррозии. При наличии контакта двух разных металлов создается гальваническая пара (V § 8 доп. 1), причем водород выделяется только на менее активном из них, который тем самым и предохраняется от коррозии. Напротив, более активней металл в этом случае разрушается быстро. Поэтому, например, ржавление оцинкованного железа, с одной стороны, и луженого – с Другой, при нарушении цельности защитного слоя протекает совершенно различно. В первом случае (А, рис. 206) местное повреждение поверхности ведет к дальнейшему разъеданию защитного слоя цинка, тогда как ржавление железазадерживается. Во втором (Б, рис. 206), начиная от поврежденного места происходит дальнейшее ржавление железа под остающимся неизменным слоем олова. Оперенными стрелками на обеих схемах рис. 206 показано направление перехода электронов в соприкасающихся металлах.
Возникновение подобных местных гальванических пар является основной причиной сравнительно быстрой коррозии загрязненных примесями металлов (ср. рис. 151). В качестве отдельных элементов пары (катода и анода) могут при этом фигурировать не только разные металлы, но и другие неоднородные части системы. Напротив, высокая однородность очень чистых металлов резко повышает их устойчивость по отношению к коррозии. Высокая коррозионная устойчивость свойственна также сплавам со структурой твердых растворов (XI § 3 доп. 2), которая характерна, в частности, для нержавеющих сталей.
14) С точки зрения ряда напряжений металл должен быть тем более подвержен коррозии, чем левее он в этом ряду расположен. Однако имеются и отступления от этого правила. Последние наблюдаются тогда, когда поверхность металла легко покрывается плотной и эластичной пленкой какого–либо почти нерастворимого в воде его соединения. Несмотря на то, что пленка эта иногда настолько тонка и прозрачна, что остается незаметной, она все же оказывается способной предохранить металл от контакта с окружающей средой и тем самым от коррозии. Примером может служить пленка Аl2 О3 на алюминии (XI § 2), вследствие наличия которой изделия из этого металла имеют слегка матовый вид и в обычных условиях практически не подвергаются коррозии.
Характерное для алюминия образование плотной защитной пленки может иметь место и у железа, но лишь в особых условиях: при контакте металла с концентрированной азотной кислотой. Образующийся слой окиси настолько тонок, что незаметен на глаз и в противоположность обычной ржавчине весьма плотен. Однако он очень хрупок, и поэтому пассивное состояние Fe легко нарушается. Гораздо более прочные защитные пленки могут быть получены путем покрытия поверхности железных изделий слоем фосфатов Мn и Fe, чем иногда и пользуются в технике (так называемое, фосфатирование).
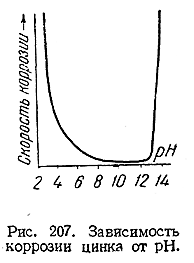
15) Всякие условия, способствующие образованию защитных пленок или повышению их прочности, будут, оче видно, увеличивать устойчивость металла по отношению к коррозии. Действующим в этом направлении веществом (ингибитором коррозии) применительно к железу является, в частности, ион ОН–. Напротив, повышение концентрации ионов Н+ (благодаря, например, растворению СОг в соприкасающейся с металлом воде) ведет к значительному ускорению коррозии. У металлов, образующих амфотерные гидроокиси, максимум коррозионной устойчивости наблюдается при некоторых средних значения pH (рис. 207).
Всякое воздействие, способствующее снятию с металла защитной пленки или ее разрыхлению, усиливает коррозию. Одним из наиболее энергичных стимуляторов последней является Сl–, действием которого обусловлено, в частности,особенно быстрое разрушение большинства металлов морской водой. Громадную роль играет содержание в воде растворенного кислорода, ускоряющего коррозию связыванием ее первичных продуктов.
В своих устойчивых соединениях Fe, Co и Ni почти исключительно двух– или трехвалентны. Для железа приблизительно одинаково характерны обе эти валентности, тогда как при переходе к кобальту и особенно к никелю значение второй из них все более отступает на задний план. Производные других валентностей рассматриваемых элементов более или менее неустойчивы и практического значения не имеют.
Кислородные соединения двухвалентных элементов семейства железа образуют ряд закисей общей формулы ЭО. Относящиеся сюда окислы – черная FeO, серо–зеленая СоО и зеленая NiO – практически нерастворимы в воде и щелочах, но легко растворимы в кислотах. Водородом при нагревании они могут быть восстановлены до металла, причем легкость такого восстановления по ряду Fe–Со–Ni несколько увеличивается.
Отвечающие окислам ЭО гидраты закисей (гидроксиды) Fe, Co и Ni общей формулы Э(ОН)2 могут быть получены только косвенным путем. Все они практически нерастворимы в воде и обычно употребляемых растворах сильных щелочей, но легко растворимы в кислотах. С химической стороны рассматриваемые гидраты характеризуются, следовательно, основными свойствами.
Общим методом получения гидроксидов Э(ОН)2 является взаимодействие растворов соответствующих солей Fe и его аналогов с сильными щелочами. Образующиеся при этом объемистые осадки – белый Fe(OH)2 , розово–красный Со (ОН)2 и яблочно–зеленый Ni(OH)2 – сильно отличаются друг от друга по отношению к кислороду воздуха. Тогда как Ni(OH)2 с ним не реагирует, а Со (ОН)2 окисляется сравнительно медленно [до коричнево–бурого Со(ОН)3 ], гидрат закиси железа по реакции
4Fe(OH)2 + О2 + 2Н2 О = 4Fe(OH)3
быстро переходит в буро–красный гидрат окиси железа. Промежуточными продуктами окисления являются различные окрашенные в грязно–зеленые тона (от бледного до почти черного), гидроксильные производные, содержащие одновременно двух– и трехвалентное железо. Поэтому чистый Fe(OH)2 может быть получен лишь при полном отсутствии кислорода (также и растворенного в реактивных жидкостях).
Образуемые двухвалентными катионами Э2+ соли сильных кислот почти все хорошо растворимы в воде, причем растворы их вследствие гидролиза показывают слабокислую реакцию. К труднорастворимым относятся многие соли сравнительно слабых кислот, в частности производные анионов СО3 2– и PO4 3– Гидратированныо ионы Э2+ окрашены в различные цвета: бледно–зеленый (Fe2+), розово–красный (Со2+) и ярко–зеленый (Ni2+).
Те же окраски характерны для образованных ими кристаллогидратов солей. Напротив, в безводном состоянии отдельные соли окрашены различно, причем цвета их не всегда совпадают с собственной окраской ионов Fe2+(бесцветный), Со2+ (красноватый) и Ni2+(желтый), а зависят также от природы аниона.
Наиболее практически важной из рассматриваемых солей является FeSO4 ·7H2 O – так называемый железный купорос. Его большие бледно–зеленые кристаллы при хранении на воздухе частично выветриваются, причем двухвалентное железо постепенно окисляется до трехвалентного:
4FeSO4 + О2 + 2Н2 О = 4Fe(OH)SO4
Подобное отношение к кислороду воздуха характерно и для большинства других солей закиси железа, тогда как соли двухвалентных кобальта и никеля на воздухе не изменяются.
Важными производными двухвалентного железа являются некоторые соли комплексной железистосинеродистой кислоты– H4 [Fe(CN)6 ]. Наиболее обычен из них хорошо растворимый в воде желтый ферроцианид калия – K4 [Fe(CN)6 ] («желтая кровяная соль»).
При переходе по ряду Fe–Со–Ni трехвалентное состояние элементов становится для них все менее характерным. В случае железа производные Fe2+и Fe3+приблизительно одинаково многочисленны как среди простых, так и среди комплексных соединений. Для Со3+ известно весьма большое число прочных комплексов, но лишь очень немного малоустойчивых простых солей. Наконец, для Ni3+вообще известны только единичные производные (причем простые его соли получить не удается).
Кислородные соединения Э3+ образуют ряд окисей. Темно–коричневая окись кобальта (Со2 О3 ) и серо–черная окись никеля (Ni2 O3 ) могут быть получены осторожным нагреванием нитратов Э(NO3 )2 которые разлагаются при этом по схеме:
4Э(NO3 )2 = 2Э2 О3 + 8NO2 + О2
С кислотами обе окиси реагируют как очень сильные окислители. Так, соляная кислота окисляется ими до свободного хлора:
Э2 О3 + 6НСl = 2ЭСl2 + Сl2 + ЗН2 О
Ввиду нерастворимости окислов Э2 О3 в воде отвечающие им гидраты Э(ОН)3 могут быть получены лишь косвенным путем. Черный Ni(OH)3 образуется при обработке Ni(OH)2 в щелочной среде такими сильными окислителями, как свободный хлор:
2Ni(OH)2 + 2NaOH + Cl2 = 2Ni(OH)3 + 2NaCl
В случае кобальта окисление гидрата закиси до коричнево–бурого Со(ОН)3 медленно идет уже под действием кислорода воздуха:
4Со(ОН)2 + О2 + 2Н2 О = 4Со(ОН)3
При взаимодействии обоих гидратов с кислотами происходит восстановление Со и Ni до двухвалентного состояния, сопровождающееся (в отсутствие способных окисляться веществ) выделением свободного кислорода, например, по схеме:
4Э(ОН)3 + 4H2 SO4 = 4ЭSО4 + О2 + 10Н2 О
16) Помимо окисления Ni(ОН)2 чисто химическим путем, перевод его в гидроокись может быть достигнут электроокислением в щелочной среде. Процесс этот, наряду с использованием для обратного получения электрического тока сильных окислительных свойств Ni(ОН)3 , лежит в основе действия т. н. щелочного аккумулятора. Последний содержит один электрод, сформованный из порошка металлического Fe, другой – из водной окиси никеля. Оба электрода опушены в раствор КОН. Процессы при разрядке и зарядке могут быть переданы схемой:
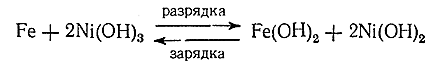
Напряжение на клеммах щелочного аккумулятора при разрядке равно приблизительно 1,3 в, при зарядке 1,8 в. В настоящее время при изготовлении щелочных аккумуляторов вместо железа часто применяют кадмий.
В отличие от свинцового (X § 5 доп. 4), щелочной аккумулятор хорошо выдерживает перегрузку и длительное пребывание в разряженном состоянии. Благодаря этому, а также сравнительно малому весу и большей устойчивости по отношению к сотрясениям, он часто применяется для обслуживания различных передвижных установок. Основным недостатком щелочного аккумулятора является его значительно меньший коэффициент полезного действия. Поэтому для больших стационарных установок предпочтительнее свинцовый аккумулятор.
Буро–красную окись железа (Fe2 O3 ) легко получить путем обезвоживания Fe(OH)3 . В отличие от гидроокисей Со3+ и Ni3+, водная скись железа часто встречается в виде различных минералов, большинство которых приближается по составу к формуле FeO(OH) (иначе, Fe2 O3 ·H2 O) и содержит, таким образом, меньше воды, чем отвечает нормальному гидрату окиси [Fe(OH)3 , т. е. Fe2 O3 ·3H2 O]. Последний может быть получен в виде красно–коричневого осадка путем осаждения щелочами растворов солей трехвалентного железа:
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3
В воде гидроокись железа практически нерастворима (но легко образует коллоидные растворы). Разбавленные кислоты быстро растворяют свежеосажденную Fe(OH)3 , причем в результате реакции получаются соответствующие соли трехвалентного железа. Гидроокись железа имеет таким образом основной характер. Наряду с этим она проявляет и слабые признаки кислотных свойств, так как заметно растворяется в горячих концентрированных растворах сильных щелочей (но не аммиака).
17) Отвечающие кислотной функции гидроокиси железа соли – ферриты аналогичны по составу алюминатам и производятся от одноосновной железистой кислоты – HFeO2 . Они могут быть получены как из растворов Fe(OH)3 в концентрированных щелочах, так и сухим путем (например, при 1100 °С по схеме:
Nа2 СО3 + Fе2 О3 = СО2 + 2NaFeO2 ).
18) В качестве производного железистой кислоты и Fe(OH)2 как основания можно рассматривать минерал магнетит (иначе, магнитный железняк) – Fe(FeO2 )2 . Отвечающая ему по составу черная закись–окись железа образуется в виде окалины при горячей обработке стальных болванок.
Соли окиси железа могут быть легко получены окислением соответствующих солей закиси Fe. Большинство из них хорошо растворимо в воде. Так как основные свойства Fe(OH)3 выражены весьма слабо, соли трехвалентного железа в растворах подвергаются далеко идущему гидролизу. Образующиеся при этом основные соли придают растворам производных Fe3+характерную для них желто–коричневую окраску. Последняя не отвечает, та–ки образом, собственной окраске иона Fe3+, который (равно как и безводный ион Fe3+) сам по себе бесцветен. При добавлении избытка кислоты гидролиз ослабляется и окраска растворов бледнеет.
Наибольшее значение из солей Fe3+имеет хлорное железо (хлорид железа (III)), обычно продающееся в виде желтого кристаллогидрата FeCl3 ·6H2 O. Получают его обработкой хлором раствора Fe в НСl, а применяется оно главным образом при производстве органических красителей. Так как FeCl3 вызывает быстрое свертывание белковых веществ, его раствором иногда пользуются для остановки кровотечений при порезах.
С соответствующими солями щелочных металлов и аммония соли трехвалентного железа часто образуют двойные соединения, примером которых могут служить железные квасцы общей формулы M[Fe(SO4 )2 ]·12H2 O. Особенно характерно комплексообразование для солей многих слабых кислот. Например, от HCN производится комплексная железосинеродистая кислота – H3 [Fe(CN)6 ], из солей которой наиболее обычен хорошо растворимый в воде феррицианид калия – K3 [Fе(CN)6 ] («красная кровяная соль»). Легко образуются также растворимые в воде комплексные соединения трехвалентного железа и многих органических веществ. На этом основано, в частности, применение лимонной кислоты для удаления с материи пятен от ржавчины.
В безводном состоянии соли Fe3+способны присоединять аммиак, однако водой подобные комплексы полностью гидролизуются. Напротив, аммиакаты трехвалентного кобальта отличаются чрезвычайной устойчивостью, и желтый комплексный .катион [Со(NН3 )6 ]3+ образует хорошо кристаллизующиеся соли с. рядом анионов, простые соли которых для Со3+ неизвестны. Замещение в нем аммиака на другие молекулы или кислотные остатки ведет к образованию множества самых разнообразных комплексных соединений трехвалентного кобальта, большинство которых вполне устойчиво и в твердом состоянии и в растворе. Примером продукта полного замещения аммиака [Со(NН3 )6 ]3+ на кислотные остатки может служить комплексный анион [Co(NO2 )6 ]3–, дающий с одновалентными катионами (кроме Li+и Na+) труднорастворимые в воде кристаллические осадки состава М3 [Со(NО2 )6 ]. Образование соответствующей желтой соли калия используется для его открытия.
19) Из других производных рассматриваемых элементов наиболее интересны соединения шестивалентного железа. При действии Сl2 (или Вr2 ) на взвесь Fe(OH)3 в горячем крепком КОН по реакции:
2Fe(OH)3 + 10KOH + 3Cl2 = 2K2 FeO4 + 6KCl + 8H2 O
образуется калийная соль железной кислоты (H2 FeO4 ). Темно–красный раствор этой соли постепенно разлагается с выделением кислорода (по реакции: 4K2FeO4 +10H2 O = 8KOH + 4Fe(OH)3 +3O2 ). При действии на него ВаСl2 выпадает фиолетово–красный осадок труднорастворимого железно–кислого бария, отвечающий составу BaFeO4 ·Н2 О. Значительно труднее выделить легкорастворимые ф е р р а т ы щелочных металлов.
Свободная железная кислота и отвечающий ей ангидрид – трехокись железа (FeO3) – не получены. При подкислении растворов железнокислых солей происходит выделение кислорода, причем железо восстанавливается до трехвалентного. Все ферраты являются чрезвычайно сильными окислителями. Например, аммиак окисляется ими по уравнению:
2K2 FeO4 + 2NH4 OH = 2Fe(OH)3 + N2 + 4KOH
Из рассмотренного выше материала вытекает, что почти все простые соединения Со и Ni являются производными двухвалентных элементов. Напротив, для железа двух– и трехвалентное состояние приблизительно одинаково характерно. Поэтому следует вкратце рассмотреть условия, при которых одно из них переходит в другое. Так как окисление или восстановление соответствующих соединений в твердом виде может идти лишь с поверхности, т. е. крайне медленно, предполагается, что они находятся в растворах.
Окисление производных двухвалентного железа протекает уже под действием кислорода воздуха. Большое значение для скорости процесса имеет реакция среды: чем выше концентрация водородных ионов, тем медленнее идет окисление. Поэтому, например, сильно подкисленный серной кислотой раствор FeSO4 сохраняется без изменения долгое время, тогда как образующийся при избытке щелочи осадок Fe(OH)2 настолько быстро окисляется, что в присутствии воздуха вообще не может быть получен чистым. Таким образом, соединения двухвалентного железа являются восстановителями более активными в щелочной среде, чем в кислой. Однако и в последней они могут быть легко окислены до соответствующих производных Fe3+действием таких сильных окислителей, как Сl2 , КМnО4 и др. В частности, реакцией по схеме
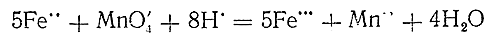
Пользуются для количественного определения ионов Fe2+.
В противоположность соединениям двухвалентного железа, производные Fe3+к воздействию кислорода воздуха вполне устойчивы. Напротив, по отношению к способным легко окисляться веществам они функционируют как окислители, притом тем более активные, чем выше в растворе концентрация водородных ионов.
Поэтому такими сильными восстановителями, как H2 S, SO2 , HJ и т. п., соли окиси железа в кислой среде легко восстанавливаются до соответствующих солей закиси. В частности, реакция по схеме
2Fe3+ + 2J– = 2Fe2+ + J2
лежит в основе одного из методов количественного определения ионов Fe3+.


